Ⅰ、某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1mol.
| 阳离子 |
K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 |
OH- HCO3- CO32- Cl- NO3- SO42- |
若向原溶液中加入足量的盐酸,有无色气体生成.经分析反应后溶液中阴离子种类没有变化.
(1)溶液中
一定不
一定不
(填“一定”、“一定不”或“可能”)含有HCO
3-或CO
32-,理由是
HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化
HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化
(2)原溶液中所含的阴离子为
Cl-、NO3-、SO42-
Cl-、NO3-、SO42-
,阳离子为
Fe2+、Mg2+
Fe2+、Mg2+
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧到恒重,得到固体质量为
120
120
g.
Ⅱ、钡盐行业生产中排出大量的钡泥[主要含有BaCO
3、BaSiO
3、BaSO
3、Ba(FeO
2)
2等].某主要生产BaCl
2、BaCO
3、BaSO
4的化工厂利用钡泥制取Ba(NO
3)
2,其部分工艺流程如下:
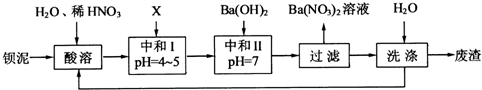
(1)酸溶后溶液中pH=1,Ba(FeO
2)
2与HNO
3的反应化学方程式为
Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O
Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O
.
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
防止反应速率过快
防止反应速率过快
、
HNO3易挥发
HNO3易挥发
、
分解
分解
.
(3)该厂结合本厂实际,选用的X为
BaCO3
BaCO3
(填化学式);中和Ⅰ使溶液中
Fe3+、H+
Fe3+、H+
(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略).
(4)上述流程中洗涤的目的是
减少废渣中可溶性钡盐对环境的污染
减少废渣中可溶性钡盐对环境的污染
.

 只可能由SO2与氯水反应产生,由此可以进一步判定一定有SO2存在。而HCl、CO2可能存在,答案选B。
只可能由SO2与氯水反应产生,由此可以进一步判定一定有SO2存在。而HCl、CO2可能存在,答案选B。

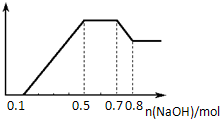 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )



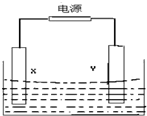 如图所示装置中,X和Y均为石墨电极.
如图所示装置中,X和Y均为石墨电极.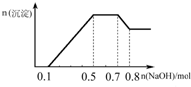 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )