
【题目】POCl3是重要的化工原料,某兴趣小组准备用三氯化磷、氯气、二氧化硫制备POC13,产物中还有一种遇水强烈水解的物质SOCl2,用下列装置完成实验。
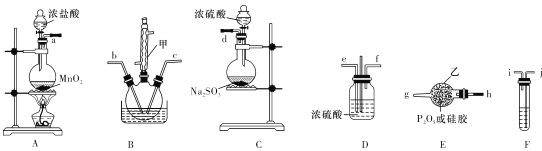
已知:PCl3熔点-93.6℃、沸点76.1℃,遇水强烈水解,易与氧气反应;POCl3遇水强烈水解,能溶于PCl3。
(1)仪器甲的名称是 ___。
(2)已知装置B制备POC13,以上仪器接口连接的顺序为a- ___b-c-g-h-d,装置F中所装试剂为 ___,装置B中发生反应的化学方程式为 ______.
(3)B中反应温度控制在60-- 65℃,其原因是 _____________
(4)用佛尔哈德法测定POC13含量:准确称取20. 20 g POCl3产品,置于盛有60. 00 ml蒸馏水的水解瓶中摇动至完全水解;将水解液配成100. 00 mL溶液,取10. 00 mL溶液于锥形瓶中;加入10. 00 mL3.200 mol/L AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;加入指示剂,用0. 200 0 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mLKSCN溶液。[已知:Ksp(AgCl) =3.2×10-10,Ksp(AgSCN) =2×10-12]
①滴定选用的指示剂是________:填字母代号),滴定终点的现象为____。
A.FeCl2 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②用硝基苯覆盖沉淀的目的是____。
③产品中POC13的百分含量为____________。
【答案】球形冷凝管 j-i-e-f 饱和食盐水 PCl3+Cl2+SO2![]() POCl3+SOCl2 温度太高,PCl3、SO2会大量挥发,导致产量下降;温度太低,反应速率会变慢 b 当最后一滴标准KSCN溶液滴入时,溶液变为红色,且半分钟不褪色 防止滴加KSCN时,将AgCl沉淀转化为AgSCN沉淀 75.99%或76%
POCl3+SOCl2 温度太高,PCl3、SO2会大量挥发,导致产量下降;温度太低,反应速率会变慢 b 当最后一滴标准KSCN溶液滴入时,溶液变为红色,且半分钟不褪色 防止滴加KSCN时,将AgCl沉淀转化为AgSCN沉淀 75.99%或76%
【解析】
用三氯化磷、氯气、二氧化硫制备POC13,从图中可以看出,应在B装置中进行。因为POCl3遇水强烈水解,所以制取的Cl2、SO2气体都必须干燥。装置A是制取Cl2的装置,此时Cl2中混有HCl和水蒸气,应使用F装置除去HCl气体,用D装置干燥,从而制得干燥、纯净的Cl2。C装置用于制取SO2,用E装置干燥。在C装置中发生制取POC13的反应,由于PCl3熔点-93.6℃、沸点76.1℃,遇水强烈水解,所以球形冷凝管的上口还应接一个能吸收Cl2、SO2,并能防止空气中水蒸气进入的装置。
(1)仪器甲的名称是球形冷凝管。答案为:球形冷凝管;
(2)由以上分析知,仪器接口连接的顺序为a- j-i-e-f -b-c-g-h-d,装置F用于除去Cl2中的HCl,所装试剂为饱和食盐水,装置B中三氯化磷、氯气、二氧化硫制备POC13,同时生成SOCl2,发生反应的化学方程式为PCl3+Cl2+SO2![]() POCl3+SOCl2。答案为:j-i-e-f;饱和食盐水;PCl3+Cl2+SO2
POCl3+SOCl2。答案为:j-i-e-f;饱和食盐水;PCl3+Cl2+SO2![]() POCl3+SOCl2;
POCl3+SOCl2;
(3)信息显示,PCl3沸点76.1℃,易挥发,所以需控制温度,B中反应温度控制在60-- 65℃,其原因是温度太高,PCl3、SO2会大量挥发,导致产量下降;温度太低,反应速率会变慢。答案为:温度太高,PCl3、SO2会大量挥发,导致产量下降;温度太低,反应速率会变慢;
(4)①因为需要控制HSCN溶液的用量,所以滴定选用的指示剂是含有Fe3+的溶液,故选B:滴定终点的现象为:当最后一滴标准KSCN溶液滴入时,溶液变为红色,且半分钟不褪色。答案为:B;当最后一滴标准KSCN溶液滴入时,溶液变为红色,且半分钟不褪色;
②因为后续操作中需加入KSCN,会使AgCl转化为AgSCN[Ksp(AgCl) >Ksp(AgSCN)],为防此反应的发生,采用硝基苯覆盖沉淀的方法,其目的是防止滴加KSCN时,将AgCl沉淀转化为AgSCN沉淀。答案为:防止滴加KSCN时,将AgCl沉淀转化为AgSCN沉淀;
③由关系式KSCN——AgNO3,可求出过量的n(AgNO3)=0.200 0 mol/L×0.01L=0.002mol,则反应POC13——3HCl——3 AgNO3中,n(AgNO3)= 3.200 0 mol/L×0.01L-0.002mol=0.03mol,从而得出n(POC13)= 0.01mol,产品中POC13的百分含量为 =75.99%或76%。答案为:75.99%或76%。
=75.99%或76%。答案为:75.99%或76%。


科目:高中化学 来源: 题型:
【题目】常温下,下列溶液均为0.1mol·L-1,有关叙述正确的是( )
A.碳酸氢钠溶液中c(H2CO3)>c(CO32-)
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中c(OH-)=c(H+)+c(H2CO3)+c(CO32-)
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的过程如下:
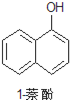 +CH3CH2OH
+CH3CH2OH![]()
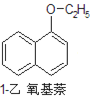 +H2O
+H2O
已知:1萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | 114.1℃ | 78.5℃ | 任意比混溶 | |
(1)将一定量1萘酚溶于无水乙醇中,并加入少量浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是__________。
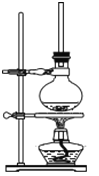
(2)装置中长玻璃管的作用是:______。
(3)该反应不能用实验室制备乙酸乙酯的装置,简述理由____________;
(4)反应结束,需要提纯产物,在下面的横线上填上相应操作的名称:倒入冷水,碱洗并_______ → 水洗并_______ →加入CaCl2干燥并______→___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业规模海水提溴的常用方法。其中一种工艺流程为:①海水浓缩,酸化;②通入Cl2,使Br— 转化为Br2;③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;④通入Cl2,再经过一系列处理得到产品Br2。请回答下列问题:
(1)步骤②、③操作的目的是_____(填“富集溴”或“萃取溴”);
(2)在步骤③中,生成HBr的化学方程式是___________;
(3)在步骤②中,若通入22.4LCl2(标准状况),理论上可得Br2__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7.2H2O),其主要工艺流程如下图:
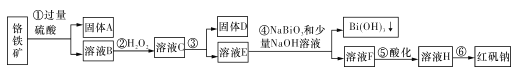
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的 pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)固体A的主要成分为____(填化学式)。
(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5.0的目的是____。
(3)写出④反应的离子反应方程式:____。
(4)取一定质量的固体D溶解于200 mL的硫酸中,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240 mL时发生反应的化学方程式为____,固体D中含铁化合物的物质的量为____

Ⅱ.经检测该化工厂的工业废水中含5.00×10-3mol/L的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Fe的化合价依次为+3、+2),又设计了如下工艺流程:
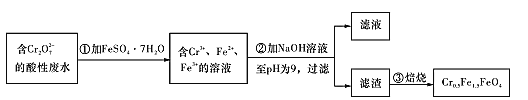
(5)第①步反应的离子方程式为____。
(6)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加FeSO4.7H2O的质量为 ___g(已知FeSO4.7H2O的摩尔质量为278 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂结构如图所示,其中W.Y.Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列说法正确的是
![]()
A.非金属性:X>W>Y
B.Y的最高价氧化为对应的水化物为三元酸
C.可利用W与X、Y形成的化合物热还原制备单质Y
D.该漂白剂中仅有X均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知: 25℃、101 kPa时,
I.H2(g) + ![]() O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/mol
II.H2(g) + ![]() O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol
试回答下列问题:
①能表示氢气燃烧热的热化学方程式为____ (填“I” 或“II”)
②H2O(g) = H2O(l) △H = ___ kJ/mol。
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
①放出的热量___41.0kJ(填“>”、“<”或“=”);
②该反应的平衡常数表达式K =__
③其他条件不变时,升高温度,c(H2)将__
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈___(填“酸性”、 “碱性”或“中性");
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=__( 已知Ksp[Fe(OH)3]= 4.0×10-38)。
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是__(填 “a”或“b”);②有关溶液变化的描述正确的是______;
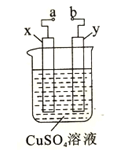
A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A.2.5 g NaD与足量水反应生成的氢气中含中子数0. 1NA
B.0.1 mol H2O与0. 1 mol H2O2含H—O键数目均为0. 2NA
C.0.1 mol Na2CO3NaHCO32H2O溶于水形成的1 L溶液中CO32一和HCO3一数目之和为0.2NA
D.电解精炼铜时,阴极增重64 g时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
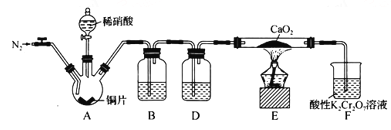
A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com