
| A. | 醋酸的电离度 | B. | 溶液的导电性 | ||
| C. | 溶液的c(OH-) | D. | 溶液中$\frac{[C{H}_{3}COO].[{H}^{+}]}{[C{H}_{3}COOH]}$ |
分析 醋酸是弱酸,存在电离平衡,在醋酸溶液中加水稀释,促进电离,溶液中氢离子浓度减小,氢氧根离子浓度增大;.D为为醋酸的电离平衡常数,温度不变,则其数值不变,以此解答该题.
解答 解:A.醋酸是弱酸,存在电离平衡.在醋酸溶液中加水稀释,促进电离,故A错误;
B.加水稀释虽然促进电离,但溶液体积增大倍数远大于离子浓度的增大,溶液浓度反而减小,则导电性减小,故B错误;
C.溶液中氢离子浓度减小,因Kw不变,则氢氧根离子浓度增大,故C错误;
D.该比值为醋酸的电离平衡常数,温度不变,则该比值不变,符合条件,故D正确;
故选D.
点评 本题考查弱电解质的电离及其影响,是高考中的常见题型,属于中等难度的试题,主要是考查学生对弱电解质电离平衡特点以及外界条件对电离平衡影响的熟悉了解程度.答题明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化程度是解答本题的关键.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
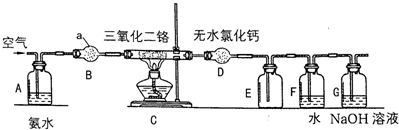
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
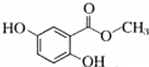
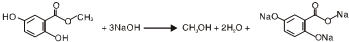 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时,给蒸发皿内液体加热时,液体不超过容器的$\frac{2}{3}$ | |
| B. | 蒸馏操作时,冷凝管中进冷凝水应是“上进下出” | |
| C. | 盛放NaOH溶液时,使用带玻璃塞的磨口瓶 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com