
����Ŀ��A��B��C��D�����ֶ�����Ԫ�أ�E�ǹ���Ԫ�أ�A��B��Cͬ���ڣ�C��Dͬ���壬A��ԭ�ӽṹʾ��ͼΪ��![]() ��B��ͬ���ڵ�һ��������С��Ԫ�أ�C�������������δ�ɶԵ��ӣ�E����Χ�����Ų�ʽΪ3d64s2���ش��������⣺
��B��ͬ���ڵ�һ��������С��Ԫ�أ�C�������������δ�ɶԵ��ӣ�E����Χ�����Ų�ʽΪ3d64s2���ش��������⣺
��1��д������Ԫ�صķ��ţ�A B C D
��2���û�ѧʽ��ʾ��������Ԫ��������������Ӧˮ����������ǿ���� ��������ǿ���� ��
��3����Ԫ�ط��ű�ʾD�������ڣ���ϡ������Ԫ���⣩��һ����������Ԫ���� ���縺������Ԫ���� ��
��4��D���⻯���C���⻯��ķе� ����������������������ԭ��
��5��EԪ��ԭ�ӵĺ˵������ ��EԪ�������ڱ���λ�� ��
��6��A��B��C���������ľ��������Ƿֱ��� ���塢 ���塢 ����
��7������Dԭ�ӵĺ�����ӹ����ʾʽ ��
���𰸡���1��Si��Na��P��N��
��2��HNO3��NaOH��
��3��F��F��
��4���ߣ�NH3���Ӽ��γ������
��5��26���������ڵ����壻
��6��ԭ�ӣ����ӣ����ӣ�
��7��![]() ��
��
�����������������A��B��C��D�����ֶ�����Ԫ�أ���A��ԭ�ӽṹʾ��ͼ��֪��x=2��A��ԭ������Ϊ14����AΪSiԪ�أ�A��B��Cͬ���ڣ�B��ͬ���ڵ�һ��������С��Ԫ�أ���BΪNaԪ�أ�C��������������ɵ����ӣ���Cԭ�ӵ�3p�ܼ���3�����ӣ���CΪPԪ�أ�C��Dͬ���壬��DΪNԪ�أ�E�ǹ���Ԫ�أ�E����Χ�����Ų�ʽΪ3d64s2��E�ĺ�������Ų�ʽΪ1s22s22p63s23p63d64s2����EΪFeԪ�أ�
�⣺A��B��C��D�����ֶ�����Ԫ�أ���A��ԭ�ӽṹʾ��ͼ��֪��x=2��A��ԭ������Ϊ14����AΪSiԪ�أ�A��B��Cͬ���ڣ�B��ͬ���ڵ�һ��������С��Ԫ�أ���BΪNaԪ�أ�C��������������ɵ����ӣ���Cԭ�ӵ�3p�ܼ���3�����ӣ���CΪPԪ�أ�C��Dͬ���壬��DΪNԪ�أ�E�ǹ���Ԫ�أ�E����Χ�����Ų�ʽΪ3d64s2��E�ĺ�������Ų�ʽΪ1s22s22p63s23p63d64s2����EΪFeԪ�أ�
��1��������������֪��AΪSi��BΪNaԪ�أ�CΪPԪ�أ�DΪNԪ�أ�
�ʴ�Ϊ��Si��Na��P��N��
��2��Ԫ�صķǽ�����Խǿ��������������Ӧˮ��������Խǿ����������ǿ����HNO3��������ǿ����NaOH��
�ʴ�Ϊ��HNO3��NaOH��
��3��D��������Ϊ�ڶ����ڣ�ͬ����������ҵ縺������һ�����ܳ��������ƣ�ϡ��������⣩���ʵ�һ���������ΪF���縺�����ΪF���ʴ�Ϊ��F��F��
��4��D���⻯��ΪNH3��C���⻯��ΪPH3����Ϊ�������Ӽ����γ������ʹ�����ķе����ߣ��е����PH3�ģ�
�ʴ�Ϊ���ߣ�NH3���Ӽ��γ������
��5��EΪFeԪ�أ�ԭ������Ϊ26��λ�����ڱ��������ڵ����壬
�ʴ�Ϊ��26���������ڵ����壻
��6��A��B��C���������ֱ�ΪSiO2O��Na2O��P2O5���������ͷֱ���ԭ�Ӿ��塢���Ӿ��塢���Ӿ��壬
�ʴ�Ϊ��ԭ�ӣ����ӣ����ӣ�
��7��D��NԪ�أ���������Ų�ʽΪ1s22s22p3�����������Ų�ͼΪ��![]() ��
��
�ʴ�Ϊ��![]() ��
��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�е�ʵ��װ����ȡ��Ȳ��
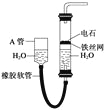
(1)��ȡ��Ȳ�Ļ�ѧ����ʽ�� .
(2)��Ȳͨ������KMnO4��Һ�й۲쵽�������� ����Ȳ������ ��Ӧ��
(3)��Ȳͨ�����CCl4��Һ����Ȳ������ ��Ӧ��
(4) ��21g CH4��C2H2�Ļ������ͨ��ʢ��������ˮ�������У���ˮ������������13g������������CH4��C2H2�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊʵ�֡���ɫ���ˡ������л��������У�����Ϊ���ܲ��ɵ��ǣ� ��
A��������ʹ������Դ
B������Ȼ���������ͺͲ�����������ȼ��
C����ֹδ�������Ĺ�ҵ��ˮ��������ˮ�������ŷ�
D������ʹ��ũҩ�������ʳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(10��)��ӦaA(g)+bB(g)![]() cC(g) ��H<0�ڵ��������½��С��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
cC(g) ��H<0�ڵ��������½��С��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
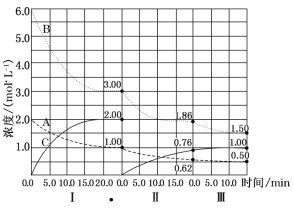
��1����Ӧ�Ļ�ѧ����ʽ�У�a:b:cΪ_______��
��2���ɵ�һ��ƽ��ڶ���ƽ�⣬�ı��������__________��
��3�� �ɵڶ���ƽ�������ƽ�⣬�ı��������_________��
��4����II��B��ƽ��ת����aII(B)=_______________��
��5������ƽ��ʱƽ�ⳣ��KI��KII��KIII�Ĵ�С˳��Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ѿ����ֵ�һ�ٶ���Ԫ���У���ϡ�������⣬�ǽ���Ԫ��ֻ��ʮ���֣������������������е���ϵ��
��1��Ϊ�����ú�������ʣ�����������Ϊ��ȼ�����壬��Ҫ��Ӧ��̼��ˮ������Ӧ����
ˮú������ѧ��Ӧ����ʽΪ ��
��2�����Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ϳɰ��ķ�Ӧ����������ʳ�����
Ӧ���£�N2(g)��3H2(g)![]() 2NH3(g)��
2NH3(g)��
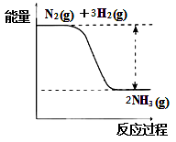
���ϳɰ��ķ�Ӧ�е������仯����ͼ��ʾ��
�÷�Ӧ�� ��Ӧ����������������������������ԭ���Ƿ�Ӧ�ﻯѧ���������յ������� ����������������С�����������ﻯѧ���γɷų�����������
����һ�������£���һ������N2��H2�Ļ���������ij�����ܱ������У�һ��ʱ���������������˵���÷�Ӧ�ﵽƽ��״̬���� ������ţ���
A�������л��������ܶȲ���ʱ��仯
B����λʱ���ڶ���3 mol H-H����ͬʱ����6 mol N-H��
C�� N2 ��H2 ��NH3�����ʵ���֮��Ϊ1:3:2
D�������л�������ƽ����Է�����������ʱ��仯
��3��Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)
+3H2(g)![]() CH3OH(g)+H2O(g)�������Ϊ1 L���ܱ������У�����1 molCO2��3 molH2�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ��
CH3OH(g)+H2O(g)�������Ϊ1 L���ܱ������У�����1 molCO2��3 molH2�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ��
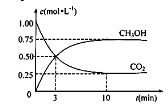
���ӷ�Ӧ��ʼ��ƽ�⣬������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v (H2)= ��
����ƽ��ʱ������ƽ��ʱ����ʼʱ��ѹǿ֮�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڵ�ء��Ͻ𡢴����ȷ���Ӧ�ù㷺��
��1�����й��ڽ�������������˵����ȷ���� ��
a�����������з������뱥����
b���������ǽ��������������ɵ��Ӽ�������
c��������������Ϊ����ӵ糡�����²������ɵ���
d���������й�������Ϊ�������������ղ��ų��ɼ���
��2��Ni��Ԫ�����ڱ��е�28��Ԫ�أ��ڶ����ڻ�̬ԭ��δ�ɶԵ�������Ni��ͬ�ҵ縺����С��Ԫ���� ��
��3�����ɽ��������Ni��CO��n������ԭ�Ӽ۵������������ṩ��������֮��Ϊ18����n= ��CO��N2�ṹ���ƣ�CO��������������������֮��Ϊ ��
��4����ȩ��H2C=O����Ni�������¼���ɵü״���CH3OH�����״�������Cԭ�ӵ��ӻ���ʽΪ ���״������ڵ�O��C��H���� ������������������������С��������ȩ�����ڵ�O��C��H���ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йظ����˵����ȷ������ ��
A��H2��D2��T2��Ϊͬ��������
B��������춡�黥Ϊͬϵ��
C��14C��C60��Ϊͬλ��
C�����ۺ���ά�ػ�Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100mL 2molL��1�������������п��Ӧ��Ϊ�ӿ췴Ӧ���ʣ��ɲ��õķ����ǣ� ��
A������������6molL��1������ B�����������Ȼ�ͭ��Һ
C����������MnO2 D�������������Ȼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�ѧ����ʽ�е���Hʵ����������ѧ�е�һ���������������ʱ䣬����ֵ�ͷ����뷴Ӧ�����������������йأ�Ҳ�뷴Ӧ���������ļ����йء�
(1)����ͼ����ʾ��ʾ����NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��________________________��

(2)ͼ����ʾ����Ԫ���е��������������������⻯��ʱ���ʱ����ݣ������ʱ����ݿ�ȷ��a��b��c��d�ֱ��������Ԫ�أ���д��������������ѧ��̬�£������ֽⷴӦ���Ȼ�ѧ����ʽ��__________________��
(3)��֪��
��Fe2O3(s)��3CO(g)===2Fe(s)��3CO2(g)����H����25 kJ��mol��1��
��3Fe2O3(s)��CO(g)===2Fe3O4(s)��CO2(g)����H����47 kJ��mol��1��
��Fe3O4(s)��CO(g)===3FeO(s)��CO2(g)����H��19 kJ��mol��1
��д��CO��ԭFeO���Ȼ�ѧ����ʽ��________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com