
下列化学反应对应的离子方程式书写正确的是( )
A. 漂白粉溶液在空气中生效:Ca2++2ClO﹣+CO2+H2O=2HClO+CaCO3↓
B. 用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣
C. 氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+
D. 0.01 mol•L﹣1NH4Al(SO4)2溶液与0.02 mol•L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3•H2O
考点: 离子方程式的书写.
分析: A.次氯酸钙与二氧化碳、水反应生成次氯酸和碳酸钙;
B.酸性环境下不能生成氢氧根离子;
C.电荷不守恒;
D.NH4Al(SO4)2与Ba(OH)2安照物质的量之比1:2反应生成硫酸钡、一水合氨和氢氧化铝.
解答: 解:A.漂白粉溶液在空气中失效离子方程式:Ca2++2ClO﹣+CO2+H2O=2HClO+CaCO3↓,故A正确;
B.用KIO3氧化酸性溶液中的KI,离子方程式:5I﹣+IO3﹣+6H+=3I2+3H2O,故B错误;
C.氯化铁溶液与铜反应:2Fe3++Cu=2Fe2++Cu2+,故C错误;
D.NH4Al(SO4)2与Ba(OH)2安照物质的量之比1:2反应生成硫酸钡、一水合氨和氢氧化铝,离子方程式:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3•H2O,故D正确;
故选:AD.
点评: 本题考查了离子方程式的书写,明确反应实质、离子方程式书写方法是解题关键,注意反应物用量对反应的影响,选项D为易错选项.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
25℃时,0.1mol•L﹣1的HA溶液中 =1010,0.01mol•L﹣1的BOH溶液pH=12.请回答下列问题:
=1010,0.01mol•L﹣1的BOH溶液pH=12.请回答下列问题:
(1)HA是 (填“强电解质”或“弱电解质”,下同),BOH是 .
(2)HA的电离方程式是 .
(3)在加水稀释HA的过程中,随着水量的增加而减小的是 (填字母).
A. B.
B.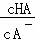 C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体 (填“多”、“少”或“相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量的CO2通入下列各溶液中,所含离子还能大量共存的是( )
A. K+、SiO32﹣、Cl﹣、NO3﹣ B. H+、NH4+、Al3+、SO42﹣
C. Na+、S2﹣、OH﹣、SO42﹣ D. Na+、CO32﹣、CH3COO﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子组在溶液中能大量共存的是( )
A. K+ NO3﹣ I﹣ H2SO3
B. Na+ Fe3+ NO3﹣ SCN﹣
C. K+ AlO2﹣ CO32﹣ Al3+
D. NH4+ Mg2+ SO42﹣ CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
用所学知识回答问题:
(1)浓硝酸久置常会显黄色,是因为 (用化学反应方程式表示),可采用 的方法消除黄色.
(2)酸性高锰酸钾溶液的氧化性比普通高锰酸钾的氧化性强,酸化时所用的酸为 ,向酸性KMnO4溶液中加入KI溶液,溶液紫红色褪去(所得溶液可使淀粉溶液变蓝),请写出KMnO4溶液褪色的离子方程式
(3)硫化氢的水溶液久置于空气中会变浑浊,请写出相关的化学反应方程式
(4)配平下面的化学方程式: Cu2O+ HNO3→ Cu(NO3)2+ NO↑+ H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学”要求从根源上减少或杜绝污染,下列对农作物收割后留下的秸秆的处理方法中,不符合“绿色化学”的是( )
A.加工成饲料 B.发酵后作农家肥
C.就地焚烧 D.制造沼气
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碰撞理论,下列说法中不正确的是( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增大,反应速率增大
C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大
D.正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com