
某有机物的结构如图所示,这种有机物不可能具有的性质是

①可以与氢气发生加成反应;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应
A. ①④ B. 只有⑥ C. 只有⑤ D. ④⑥
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是

A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
硫的化合物在生产生活中有广泛应用。
(1)硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:
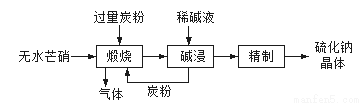
① 上述流程中采用稀碱液比用热水更好,理由是__________________。
② 取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)=______mol·L-1。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(2)工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3。KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用0.01000 mol·L?1 KIO3酸性标准溶液滴定至终点,消耗KIO3溶液31.25mL。
① 滴定终点观察到的现象为:_____________________。
② 成品中Na2SO3的质量分数是_________(请写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
2017年元旦期间,全国大部分地区迎来“新年霾”。下列做法与“雾霾”的防护与治理相违背的是
A. 开发利用清洁能源 B. 工厂使用低硫煤
C. 增加植被面积 D. 大力提倡燃煤供暖
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三2月联考化学试卷(解析版) 题型:选择题
常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如下图所示,列有关叙述正确的是( )

A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三2月联考化学试卷(解析版) 题型:选择题
分类是科学研究的重要方法,下列物质分类不正确的是( )
A. 化合物:干冰,冰水混合物,烧碱 B. 同素异形体:活性炭,C60,金刚石
C. 非电解质:乙醇,四氯化碳,氯气 D. 混合物:漂白粉,纯净矿泉水,盐酸,
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省淮安市高一上学期期末调研测试化学试卷(解析版) 题型:选择题
氨气可以用来处理氮氧化物,例如氨气与二氧化氮发生如下反应:6NO2+8NH3 7N2+12H2O,下列关于该反应说法正确的是
7N2+12H2O,下列关于该反应说法正确的是
A. NH3是氧化剂 B. H2O是氧化产物
C. NO2发生氧化反应 D. 生成1 mol H2O转移2 mol的电子
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷(解析版) 题型:推断题
某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式____________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是__________________。
(3)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如下图所示,“则A与B溶液”反应后溶液中的溶质为__________(填化学式)。

(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所能观察到的实验现象是____________________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚后溶液显紫色,则由A转化成E的离子方程式是_______________ ;
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,请写出足量E与D反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期二调考试理综化学试卷(解析版) 题型:实验题
铜是一种重要的战略物资,以黄铜矿(主要成分是CuFeS2)为主要原料生产铜、铁红、单质硫时,原料的综合利用率较高,其主要流程如图所示(己知Na[CuCl2]的电离方程式为:Na[CuCl2]=Na++[CuCl2]-):
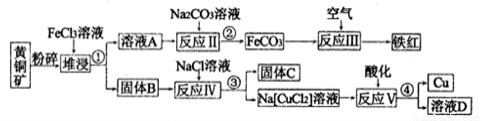
(1)流程中粉碎的目的是_____________,操作①、②、③、④的目的相同,在实验中这种操作的名称是____________。
(2)铁红的重要用途:__________________,固体B中含有两种产物,一种是单质C、另一种是原子个数比为1:l 的一种金属的低价态盐,写出堆浸时反应的化学方程式:________。
(3)反应V的离子方程式:___________________。
(4)此方法中得到的铜纯度不能满足某些生产的需要,需要利用电解法进行提纯。若用如图所示的装置进行电解精炼,则乙中溶液的溶质是_________,e电极上的电极反应式为_____。

若当电路中有2mol电子通过时,乙中某个电极质量减轻了63.92g,则粗铜的纯度为(假设杂质只有铁且精炼时铜与铁的放电比例与混合物比例相同,计算时用%表示保留一位小数)____________(已知相对原子质量:Fe 56 Cu 64 )。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com