
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. lmol单质Fe与足量的高温水蒸气反应,失去3NA个电子
B. 27g铝中加入1L 1 mol/L的NaOH溶液,转移电子数是3NA
C. 50mll2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
【答案】B
【解析】A.四氧化三铁中铁元素的化合价为+![]() 价,1mol与水蒸气完全反应生成四氧化三铁转移的电子的物质的量为
价,1mol与水蒸气完全反应生成四氧化三铁转移的电子的物质的量为![]() mol,则反应转移
mol,则反应转移![]() NA个电子,故A错误;B.27g铝的物质的量为1mol,Al原子最外层电子数是3,反应中易失去,则1molAl加入1L 1 mol/L的NaOH溶液,完全反应转移电子数是3NA,故B正确;C.MnO2只能溶于浓盐酸,当反应不断进行进,盐酸浓度降低变为稀盐酸后,反应会停止,则50mll2mol/L盐酸与足量MnO2共热,转移的电子数小于0.05NA,故C错误;D.CO2与Na2O2反应生成氧气,Na2O2既是氧化剂,又是还原剂,标准状况下,5.6LCO2的物质的量为0.25mol,足量Na2O2反应转移的电子数为0.25NA,故D错误;答案为B。
NA个电子,故A错误;B.27g铝的物质的量为1mol,Al原子最外层电子数是3,反应中易失去,则1molAl加入1L 1 mol/L的NaOH溶液,完全反应转移电子数是3NA,故B正确;C.MnO2只能溶于浓盐酸,当反应不断进行进,盐酸浓度降低变为稀盐酸后,反应会停止,则50mll2mol/L盐酸与足量MnO2共热,转移的电子数小于0.05NA,故C错误;D.CO2与Na2O2反应生成氧气,Na2O2既是氧化剂,又是还原剂,标准状况下,5.6LCO2的物质的量为0.25mol,足量Na2O2反应转移的电子数为0.25NA,故D错误;答案为B。


科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时m g 该晶体溶于ng水中,得到V mL 密度为d g· mL-1 的饱和溶液,下述表达式或判断正确的是( )
A. 该溶液物质的量浓度为(m/BV)mol·L-1
B. 60℃时A 的溶解度为(100m(B-18)/nB)g
C. 该溶液溶质的质量分数为(m/(m+n))×100%
D. 60℃时,将10g A 投入到该饱和溶液中,析出的晶体质量大于10g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的状态除了气态、液态、固态外,还有玻璃态。它是由气态水急速冷却到165K时形成的,玻璃态水无固定形态,不存在晶体结构,且密度与普通液态水的密度相同。下列有关玻璃态水的说法中正确的是( )
A. 水由液态变为玻璃态,体积缩小 B. 水由液态变为玻璃态,体积膨胀
C. 玻璃态水是水的一种特殊状态 D. 玻璃态水属于晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入X后会发生如下反应:5X(g) ![]() 2Y(g)+Z(g) ΔH<0,测得X的物质的量n(X)随时间t的变化如右图曲线Ⅰ所示,若改变某一条件后,向同种规格的密闭容器中加入等量的X后,测得n(X)随时间t的变化如右图曲线Ⅱ所示,下列说法错误的是
2Y(g)+Z(g) ΔH<0,测得X的物质的量n(X)随时间t的变化如右图曲线Ⅰ所示,若改变某一条件后,向同种规格的密闭容器中加入等量的X后,测得n(X)随时间t的变化如右图曲线Ⅱ所示,下列说法错误的是
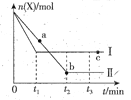
A. 曲线Ⅰ、曲线Ⅱ对应的反应只能是温度不同,且T(Ⅰ)>T(Ⅱ)
B. a、b、c三点对应的气体的平均相对分子质量:a>c>b
C. 平衡时Z的产率:b>c
D. t2-t3时间段内,两种条件下X的平均反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔(C2H2).
(1)CaC2中C22﹣与O22+互为等电子体,O22+的电子式可表示为;1mol O22+中含有的π键数目为 .
(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH﹣C≡N).丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常为有机溶剂,其中分子结构为正四面体的是 . 工业上分离这些多氯代物的方法是 .
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式(不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下: ![]()
反应①的化学方程式为 , 反应类型为;反应②的反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.ΔH<0,ΔS>0的反应在温度低时不能自发进行
B.在其他条件不变时,增大反应物的浓度,可以增大活化分子百分数
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.NH4HCO3(g)===NH3(g) +H2O(g)+CO2(g) ΔH =+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com