
【题目】我国拥有自主知识产权的铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是( )
A.元素的金属性:K>Rb
B.中子数为50的Rb的核素:![]() Rb
Rb
C.与同周期元素53I的原子半径比:Rb<I
D.最高价氧化物对应的水化物的碱性:KOH<RbOH
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+![]() O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。

(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中![]() 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时![]() 的配比是___。
的配比是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号字母),然后测定溶液的pH。
A.固体CH3COOK | B.固体CH3COONH4 |
C.气体NH3 | D.固体NaHCO3 |
(3)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”、“减小”或“不变”)(已知25 ℃ 时,CH3COONH4溶液呈中性)。
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液。判断:
①溶液中共有________种粒子。
②溶液中有两种粒子的物质的量的和一定等于0.010 mol,它们是________和________。
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图所示实验。
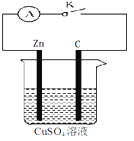
(1)打开K,观察到的现象为 ,
(2)关闭K,观察到的现象是 ,
此电池的负极的电极反应式为 ,
总反应式为 。
(3)关闭K,溶液中阳离子向 (填Zn或C)极运动,
外电路中,电子流动方向是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生反应X2+2Y22Z (X、Y、Z都为气体)。已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.4 mol·L-1
B.Y2为0.5 mol·L-1
C.X2为0.2 mol·L-1
D.Z为0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法不正确的是( )
A.1molO2含有的电子数为16NA
B.0.1mol·L-1碳酸钠溶液含有的CO![]() 数目为0.1NA
数目为0.1NA
C.8gS在足量中氧气完全燃烧转移的电子数为NA
D.标准状况下22.4L甲烷中共价键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
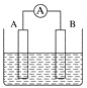
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气中的二氧化硫和氮氧化物是大气主要污染物,脱硫脱氮是环境治理的热点问题。回答下列问题:
(1)已知氮及其化合物发生如下反应:
N2(g)+O2(g)![]() 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
N2(g)+2O2(g)![]() 2NO2(g) ΔH=+68kJ·mol-1
2NO2(g) ΔH=+68kJ·mol-1
则2NO(g)+O2(g)![]() 2NO2(g)ΔH___kJ·mol-1。
2NO2(g)ΔH___kJ·mol-1。
(2)利用KMnO4脱除二氧化硫的离子方程式为:___
①□MnO![]() +□SO2+□H2O
+□SO2+□H2O![]() □MnO
□MnO![]() +□ +□ 。(在“□”里填入系数,在“__”上填入微粒符号)
+□ +□ 。(在“□”里填入系数,在“__”上填入微粒符号)
②在上述反应中加入CaCO3可以提高SO2去除率,原因是___。
(3)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I.CaSO3(s)+SO![]() (aq)
(aq)![]() CaSO4(s)+SO
CaSO4(s)+SO![]() (aq)
(aq)
II.SO![]() (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)![]() SO
SO![]() (aq)+2NO
(aq)+2NO![]() (aq)+2H+(aq)
(aq)+2H+(aq)
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图所示。
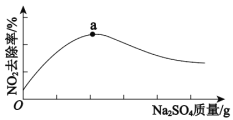
a点后NO2去除率降低的原因是___。
(4)检测烟道气中NOx含量的步骤如下:
I.将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO![]() ;
;
II.加水稀释至100.00mL,量取20.00mL该溶液,与V1mLc1mol·L-1FeSO4标准溶液(过量)充分混合;
III.用c2mol·L-1KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2mL。
①NO被H2O2氧化为NO![]() 的离子方程式为___。
的离子方程式为___。
②滴定过程中主要使用的玻璃仪器有___和锥形瓶等。
③滴定过程中发生下列反应:
3Fe2++NO+4H+=NO↑+3Fe3++2H2O
MnO![]() +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
烟气气样中NOx折合成NO2的含量为__mg·m-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
B. ![]()
![]()
![]() (正反应为放热反应)
(正反应为放热反应)
C. H2(g)+I2(g)![]() 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
D. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com