
科目:高中化学 来源: 题型:
 已知Fe(OH)2是白色难溶于水的物质,很容易被空气中的氧气氧化为Fe(OH)3.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其它试剂自选.请填写下列空白:
已知Fe(OH)2是白色难溶于水的物质,很容易被空气中的氧气氧化为Fe(OH)3.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其它试剂自选.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2013届山东省新泰市汶城中学高三12月月考化学试卷(带解析) 题型:实验题
(8分)已知Fe(OH)2是白色难溶于水的物质,很容易被空气中的氧气氧化为Fe(OH)3。如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6mol/L的硫酸,其它试剂自选。
请填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 ;
(2)实验开始时应先将活塞E (填“打开”或“关闭”),C中收集到的气体的主要成份是 ;
(3)简述生成Fe(OH)2的操作过程
(4)(3)操作后拔出装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(18分)下列八个步骤是用来分析一种含铅锡的合金中铅和锡的个别含量
(1)称量0.4062g的合金,放在烧杯中,用11mol?L-1的HCl和16mol?L-1的HNO3溶液溶解样品。在此过程中铅和锡分别被氧化成Pb(II)、Sn(VI)。
(2)再加热5分钟,以赶走氮和氯的氧化物后,使溶液冷却;此时会有一些锡化合物和一种铅化合物沉淀出。
(3)加入25.00mL 0.2000mol?L-1的Na2H2EDTA(可用H2Y2-表示)溶液后,沉淀会溶解成一透明无色的溶液。
(4)上述溶液全部移入250.0mL的量瓶中,并用蒸馏水稀释到量瓶的刻度上。
(5)拿出25.00mL,加入30%的Hexamine(如下图)溶液15mL、H2O及两滴的类苯酚橙(以XO代表)(如下图)当指示剂,此溶液的pH值为6。
(6)再用标准0.009970mol?L-1的硝酸铅Pb(NO3)2 溶液滴定从第(5)步骤中的黄色透明的溶液,直至颜色刚好由黄色变到红色,此实验值为24.05mL。
(7)取2.0g的固体NaF加入滴定瓶中,此时溶液会变回黄色。
(8)再用0.009970mol?L-1的硝酸铅滴定到颜色变红,此实验值为15.00mL。
Hexamine和类苯酚橙(XO)的结构式如下:

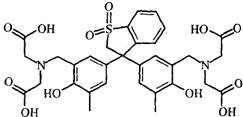
Hexamine 类苯酚橙(XO)
Hexamine的pKb =9.5。类苯酚橙(XO)在pH小于4时是红色,pH大于5时是黄色
回答下列问题
10-1 在步骤(2)中铅的沉淀物是什么?写出其化学式。
10-2 写出步骤(3)中沉淀消失的离子反应方程式(必须平衡)?记得此溶液的pH值为6。
10-3 步骤(5)中为何加入Hexamine?
10-4 加入类苯酚橙(XO)的目的为何?
10-5 写出步骤(6)中,(i)在滴定过程中,以及(ii)滴定终点造成颜色变化时的平衡离子反应方程式。
10-6 步骤(7)中,加入NaF的目的为何?
10-7 写出步骤(7)中的平衡离子方程式。
10-8 用平衡的离子方程式来说明为什么步骤(7)中的颜色会由红变为黄?用XO代表类苯酚橙。
10-9 计算此合金中Pb的重量百分比,再另外计算此合金中Sn的重量百分比。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Fe(OH)2是白色难溶于水的物质,很容易被空气中的氧气氧化为Fe(OH)3。如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6mol/L的硫酸,其它试剂自选。
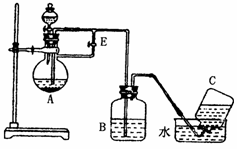
请填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 ;
(2)实验开始时应先将活塞E (填“打开”或“关闭”),C中收集到的气体的主要成份是 ;
(3)简述生成Fe(OH)2的操作过程
;
(4)(3)操作后拔出装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com