
��amolNaOH��amolNa2CO3�Ļ����Һ��ͨ��bmolCO2��ַ�Ӧ��������CO2���ܽ⣩������˵������ȷ����
A. ��a��2bʱ�����������ӷ�ӦΪ��2OH-+CO2=CO32-+H2O
B. ��a=1.25bʱ�����������ӷ���ʽΪ��5OH-+4CO2=3HCO3-+CO32-+H2O
C. 2b/3<a<2bʱ����Һ��CO32-��HCO3-���ʵ���֮��Ϊ��(2b-a):(2a-b)
D. ����Ӧ����Һ��CO32-��OH-���ʵ���֮��Ϊ2:1����5b=a

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꼪��ʡ�߶���ѧ�ڻ���ѵ����15����ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ӵ�������NA��ʾ������������ȷ����
��22g T2O���е�����Ϊ10 NA
��0.44gC3H8�к��еĦҼ�����ĿΪ0.1NA
��1 mol Na2O2��CO2��ȫ��Ӧʱת�Ƶ�����Ϊ2NA
��28 g �辧���к���2 NA��Si��Si��
��11.2LCl2ͨ����������������Һ�г�ַ�Ӧ��ת�Ƶĵ���������0.5NA
��200 mL��1 mol/L Al2��SO4��3��Һ�У�Al3+��SO42-���������ܺ���NA
���ڳ��³�ѹ�£�0.1mol����0.1mol Cl2��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.3 NA
��O2��O3�Ļ���ﹲ6.4g����������ԭ����һ��Ϊ0.4 NA
A. �٢ڢۢݢ� B. �ڢܢޢߢ� C. �٢ۢݢޢ� D. �٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и߶�����ʵ�����ѧ�ڵ�һ���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
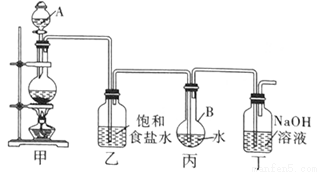
��1��д��װ�ü��з�����Ӧ�Ļ�ѧ����ʽ�� ��
װ�ü��е�����ʹ��ǰ��Ҫ��©���� ��д���ƣ���
��2������װ�ñ���ȡ������ˮ������pHֵ��
��֤����ˮ�ѱ��͵������� ��
�ڲⶨ������ˮ��pH������ ��
������ȥװ���ң�ֱ�ӽ�װ�üͱ���������������ʵ��ⶨ�����Ӱ���� ��
��3��������ˮ��ʯ��ʯ�ķ�Ӧ����ȡ��Ũ��HClO��Һ�ķ���֮һ��ijͬѧ������һ������������ȡHClO��Һ�����������¶���ʵ�飺
i�����Թ��м�������Ŀ�״̼��ƣ��ټ���Լ20ml������ˮ����ַ�Ӧ�����������ݲ�������Һ�Ļ���ɫ��ȥ��
ii�����ˣ�����Һ������ɫ�����ϣ�������Ư���Ը�ǿ��
iii��Ϊ��ȷ����Ӧ�������Һ��Ϊ���ݣ��ֱ��������ʵ�飺
��һ����ʯ��ˮ��ϣ���������������ɫ������
�ڶ�����ϡ�����ϣ����̲����������ݣ�
�����ݼ��ȣ�������Һ��������д�����ɫ���������
����⣬����ʵ���в�������ɫ�����ΪCO2���塣
�� �Խ��Ϳ����ڱ�����ˮ�м���ʯ��ʯ�Ʊ�HClO��ԭ�� �������йصķ���ʽ������ֻش�
���Ը�����ѧ֪ʶ�Ʋ⣬��ii����Һ�к��е����ʣ������ܽ�ļ����������⣬�����е���������Ϊ ��д��ѧʽ����
��д������iii�е�һ����Һ������Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ��һ�������������Բ��ԣ��ģ���b�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������е������۾���ȷ���Ҵ��������ϵ����
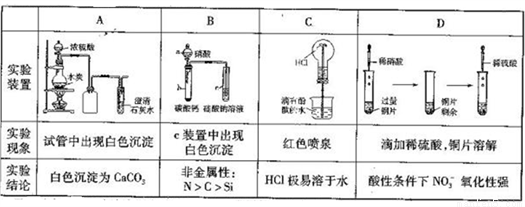
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ������2017�����1�½�ѧ������⻯ѧ�Ծ� ���ͣ�������
���ۡ�ͭ�ۻ������Ʒ11.6g������2.0 mol/L����������Һ����ַ�Ӧ��ʣ��������������������Һ����仯���±���
������Һ/mL | 20.0 | 40.0 | 60.0 | 80.0 |
ʣ�����/g | 9.36 | 7.12 | 4.88 | 3.20 |
��ش�
(1)��Ʒ������ͭ�����ʵ���֮��n(Fe����n(Cu)=________ ��
(2)�ڷ�Ӧ�����ϵ�У��ټ���4.0mol/L��H2O2��Һ25.0mL������������������Һ����ַ�Ӧ����Һ�д��ڵĸ��������ӵ����ʵ����ֱ��Ƕ��٣�__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ������2017�����1�½�ѧ������⻯ѧ�Ծ� ���ͣ�ѡ����
��֪��������ͣ�����C8H18��ʾ����ȼ�յ��Ȼ�ѧ����ʽ��
CH4(g)+2O2(g) CO2(g)+2 H2O(l) ��H=��890 kJ • mol��1��
CO2(g)+2 H2O(l) ��H=��890 kJ • mol��1��
C8H18(l)+12.5 O2(g) 8CO2(g)+9H2O(l) ��H=��5472 kJ • mol��1��
8CO2(g)+9H2O(l) ��H=��5472 kJ • mol��1��
ijѧУʳ����ѡ����Ȼ����Ϊ����ȼ�ϣ�����ѡ�����ݲ���ȷ����
A. �����������ͺͼ���ȼ�գ�������������������Ͷ࣬��˼������Ч
B. ������ͬ���������ɵĶ�����̼�����ͱȼ���࣬��˼������Ч
C. ���麬̼���ͣ�ȼ�ո���֣�����̿�����ײ���CO����˸�����
D. �����ʵ��������ͺͼ���ȼ�գ����Ͳ����������ȼ���࣬��˸�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ������2017�����1�½�ѧ������⻯ѧ�Ծ� ���ͣ�ѡ����
һ�������£�0.3molX(g)��Y(g)���ݻ��̶����ܱ������з�����Ӧ��X(g)+3Y(g)  2Z(g), ��H=-aKJ/mol������˵����ȷ����
2Z(g), ��H=-aKJ/mol������˵����ȷ����
A. ��Ӧһ��ʱ���X��Y�����ʵ���֮����Ϊ1:1
B. �ﵽƽ��ʱ���ҷ�Ӧ�ų�0.1aKJ������
C. �ﵽƽ�������ƽ����ϵ�г����������壬Z������Ӧ���ʽ��������仯
D. X������������ֲ��䣬˵����Ӧ�Ѵﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�Ͼ��и߶�ѧҵˮƽģ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ӧ2NaClO3��Na2SO3��H2SO4===2ClO2����2Na2SO4��H2O���Ʊ���Ч������ClO2�����ڸ÷�Ӧ��˵����ȷ����
A. NaClO3������ B. Na2SO3�ǻ�ԭ��
C. H2SO4�������� D. ÿ����1 mol ClO2ת��2 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�찲��ʡ������ʮУ������3���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������һ�ֿɳ���أ������ͼ������ʾ������������Zn������������Zn(OH)2������������K2FeO4(������)����ԭ������Fe(OH)3���������Һ��KOHˮ��Һ�������й�˵����ȷ����
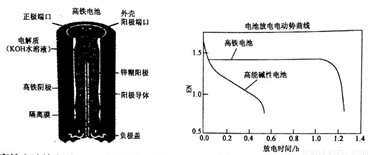
A. ������طŵ�ʱ������ӦΪ��Zn+2OH--2e-=Zn(OH)2
B. ������س��ʱ������ӦΪFe(OH)3+5OH--3e-=FeO42-+4H2O
C. ������طŵ�ʱ���ܷ�ӦΪ��2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-
D. ���ܼ��Ե�رȸ�����ع�����ѹ���ȶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com