
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )

A. 镁作Y电极
B. 电池工作时,Na+向负极移动
C. 废液的pH大于NaClO溶液的pH
D. X电极上发生的反应为ClO-+2H2O - 4e-═ClO3-+4H+
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 1molO2在任何情况下都是32g B. 摩尔是一个基本物理量
C. H2SO4的摩尔质量是98g D. 1摩尔氢的质量是2g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:简答题
Ⅰ、运用铁及其化合物的知识,完成下列各题。
(1)下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是________。
A.盐酸 B.氯气 C.CuSO4溶液 D.稀硫酸
(2)把过量的铁粉加入稀硝酸中,其结果是________。
A.不反应 B.生成硝酸铁 C.生成硝酸亚铁
(3)要除去FeCl2溶液中的少量FeCl3,可行的办法是________。
A.滴入KSCN溶液 B.通入氯气 C.加入铜粉 D.加入铁粉
Ⅱ、工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。
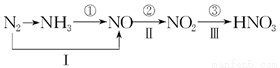
(1)写出①步反应的化学方程式:____________________________________________________。
(2)下列环境问题与NO2的排放有关的是________(填字母序号)。
A.赤潮 B.光化学烟雾 C.臭氧空洞 D.温室效应 E.酸雨
(3)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),则所消耗的硝酸的物质的量是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列仪器常用于物质分离的是( )
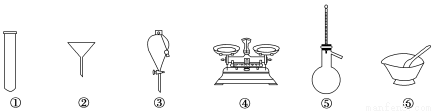
A. ①③⑤ B. ②③⑤ C. ②④⑤ D. ①②⑥
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:简答题
A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去).
A 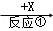 B
B  C
C
试回答:
(1)若X为O2,则A不可能是______(填选项)
a.NH3 b.Mg c.S d.Si
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B溶液显碱性的原因____________________,举出C的一种用途_____________________
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式__________________C的水溶液中各离子浓度由大到小顺序为_______________________.
(4)若A为单质,C为红棕色气体。写出少量Fe粉与组成A物质的元素的最高价氧化物的水化物的稀溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如下图,其中只有M为金属元素。下列说法不正确的是( )
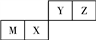
A. 原子半径Z < M
B. Y的最高价氧化物对应水化物的酸性比X 的弱
C. X 的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第二周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
已知:I2+2S2O32-=S4O62-+2I-
相关物质的溶度积常数见下表:
物质 | Cu(OH)2蓝色 | Fe(OH)3红褐 | CuCl白色 | CuI白色 |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.02×10-6 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入___________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是__________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
可选用_________作滴定指示剂,滴定终点的现象是________________。
CuCl2溶液与KI反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
①10℃时10 mL 0.1 mol·L-1的Na2S2O3溶液和50 mL0.05 mol·L-1的H2SO4溶液;
②10℃时10 mL 0.05 mol·L-1的Na2S2O3溶液和10 mL 0.1 mol·L-1的H2SO4溶液;
③30℃时10 mL 0.05 mol·L-1的Na2S2O3溶液和10 mL 0.1 mol·L-1的H2SO4溶液。
若同时将它们混合发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,则出现浑浊的先后顺序是( )
A. ①②③ B. ②①③ C. ③②① D. ①③②
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
银-Ferrozine法检测甲醛(HCHO)的原理为①在原电池装置中,氧化银能将甲醛充分氧化为CO2;②Fe3+与产生的Ag定量反应生成Fe2+;③Fe2+与Feirozine形成有色配合物;④测定溶液的吸光度(吸光度与溶液中有色物质的浓度成正比)。下列说法正确的是
A. ①中,负极上消耗1 mol甲醛时转移2 mol电子
B. ①溶液中的H+由正极移向负极
C. 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4
D. ④中,甲醛浓度越大,吸光度越小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com