

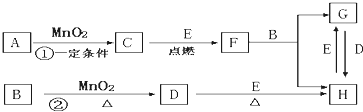
根据图示关系填写下列空白:
(1)写出下列物质的化学式:A________________,D________________。
(2)C粉末与D的混合物通常叫________________(填名称)。
(3)写出I+J→K的离子方程式_______________________________________________。
(4)写出G→H的化学方程式________________________________________________。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:湖南师大附中2006-2007学年度上学期高三月考试卷(四)、化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:

请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)__________;若反应①是在常温条件下进行的,则A是____________________(填化学式);若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为____________________.
(2)H用途广泛如用作催化剂、印刷电路腐蚀剂和外伤止血剂及净水等.若将Cu棒与C棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为: ____________________.总离子方程式为:____________________.F与B反应的离子方程式为: ____________________.
(3)经测定A为二元弱酸,其酸性比碳酸弱,写出A在水溶液中的电离方程式: ____________________.A与氨气反应生成的酸式盐的化学式为:____________________.若将适量MnO2加入酸化后的A溶液中,MnO2溶解产生Mn2+,该反应的离子方程式为: ____________________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省孝感市高三第二次统考理综化学试卷(解析版) 题型:填空题
MnO2、KMnO4等是中学化学中的常用试剂。请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂。若将MnO2加入酸化的H2O2溶液中,MnO2 溶解产生Mn2+,反应的离子方程式是??????????????????????????????????????????????? 。
(2)用MnO2制KMnO4的工艺流程如图
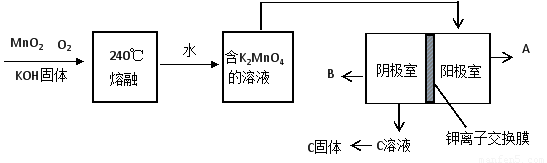
电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式????????????????????????????????????? ,投料时必须满足n(KOH):n(MnO2) ?????????? 。
②阳极的电极反应为??????????????????????????????????? 。
③B物质是????????? (写化学式,下同),可以循环使用的物质是???????????????????? 。
④钾离子交换膜的一种材料是聚丙烯酸钾(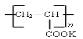 ),聚丙烯酸钾单体的结构简式为??????????? 。
),聚丙烯酸钾单体的结构简式为??????????? 。
⑤上述制得的KMnO4产品0.165 g,恰好与0.335 g经硫酸酸化的Na2C2O4反应完全,该KMnO4的
纯度是??????????? (精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
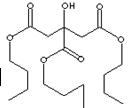
(10分)TBC是优良的增塑剂,具有很好的相容性,且挥发性小、耐寒、耐光及耐水等,广泛用于医学卫生用品,它的结构式如下图,合成时柠檬酸与正丁醇合成数据如下:
下表中实验数据均为用活性炭固体杂多酸作催化剂,实验时催化剂总量占原料的1%,实验结果如下表。表1:酸醇物质的量之比对酯化率的影响;表2:酯化时间对酯化率的影响;表3:酯化率随温度变化情况。
表1 | n(酸)n(醇) | 15.0 | 15.5 | 16.0 | 16.5 | 17.0 |
酯化率/% | 95.1 | 96.3 | 97.0 | 97.4 | 97.2 | |
表2 | 时间/h | 0.5 | 1.0 | 2.0 | 3.0 | 5.0 |
酯化率/% | 40.0 | 70.2 | 94.3 | 97.4 | 97.4 | |
表3 | 温度/℃ | 130 | 140 | 145 | 150 | 160 |
酯化率/% | 89.5 | 96.2 | 97.4 | 97.4 | 97.2 |
试回答下列问题
(1)酯化反应适宜的条件n(酸)∶(醇)、时间/h、温度/℃分别是: (选填序号)。
 A.1∶5,1,130 B.1∶5.5 ,1,140
A.1∶5,1,130 B.1∶5.5 ,1,140
C.1∶7 ,2,160 D.1∶6.5 ,3,145
(2)温度太高酯化率降低的可能原因是
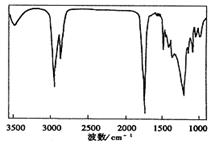
(3)TBC的一种标准谱图如右,它是
(A、1H-NMR图谱 B、红外光谱 C、质谱)
(4)TBC与足量NaOH溶液反应的化学方程式: 。(5)柠檬酸的一种同分异构体A,能发生如下转化: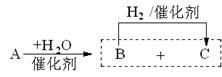
A可能的结构式为: (只写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com