
【题目】SO2是常见的硫氧化物,在化工、生活等领域中应用广泛。
I如图是实验室制取SO2并验证SO2某些性质的装置图
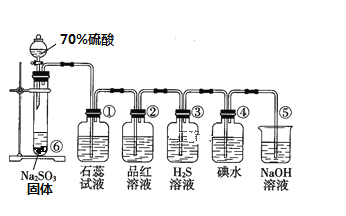
(1)⑥中发生反应的化学方程式为_________________________________
(2)③中实验现象为_____________________________________,证明SO2有____性
(3)⑤中离子反应方程式为______________________
II某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)pH试纸颜色的变化说明漂粉精溶液具有的性质是_________________
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是_______________________________________________
②由实验a、b不能判断白雾中含有HCl,理由是_______________________________________
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀,则沉淀X中含有的物质是___________
②用离子方程式解释现象iii中黄绿色褪去的原因 ___________________________
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 有淡黄色沉淀产生 氧化 SO2+2OH-=SO32-+ H2O 碱性、漂白性 检验白雾中是否含有氯气,排除干扰 白雾中混有SO2,SO2可与硝酸银反应 CaSO4 SO2+Cl2+2H2O=SO42-+2Cl-+4H+
【解析】
I(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体;
(2)③中二氧化硫与硫化氢发生氧化还原反应生成单质S;
(3)⑤的作用是吸收二氧化硫,防止二氧化硫污染空气;
II(1)漂粉精的pH约为12,大于7,说明溶液显碱性,后褪色说明具有漂白性;
(2)①实验a的目的是检验白雾中是否含有氯气;
②白雾中混有SO2,可以被硝酸氧化为硫酸,硫酸与AgNO3溶液反应生成硫酸银白色沉淀;
(3)①取上层清液,加入BaCl2溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸和硫酸。
I(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为:
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)③中二氧化硫与硫化氢发生氧化还原反应生成单质S,SO2+2H2S=3S↓+2H2O,实验现象为有淡黄色沉淀产生,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性,故答案为:有淡黄色沉淀产生;氧化;
(3)⑤的作用是吸收二氧化硫,防止二氧化硫污染空气,化学方程式为:
SO2+2NaOH=Na2SO3+ H2O,离子反应方程式为SO2+2OH-=SO32-+ H2O,故答案为:SO2+2OH-=SO32-+ H2O;
II(1)漂粉精的pH约为12,大于7,说明溶液显碱性,后褪色说明具有漂白性,故答案为:碱性、漂白性;
(2)①实验a的目的是检验白雾中是否含有氯气,如果有氯气,湿润的碘化钾淀粉试纸变蓝,故答案为:检验白雾中是否含有氯气,排除干扰;
②白雾中混有SO2,可以被硝酸氧化为硫酸,硫酸与AgNO3溶液反应生成硫酸银白色沉淀,故答案为:白雾中混有SO2,SO2可与硝酸银反应;
(3)①取上层清液,加入BaCl2溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4,故答案为:CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸和硫酸,反应方程式为
SO2+Cl2+2H2O=SO42-+2Cl-+4H+,故答案为: SO2+Cl2+2H2O=SO42-+2Cl-+4H+。


科目:高中化学 来源: 题型:
【题目】将物质的量均为amol的Na 和Al一同投入mg足量水中,所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度为( )
A. 1000aρ/(46a+m)mol·L-1 B. 4ρ/(46a+m)mol·L-1
C. 1000aρ/(50a+m)mol·L-1 D. 1000aρ/(45a+m)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
NaCl | MgCl2 | AlCl3 | SiCl4 | CaCl2 | |
熔点/℃ | 801 | 712 | 190 | -68 | 782 |
沸点/℃ | 1 465 | 1 418 | 230 | 57 | 1 600 |
根据这些数据分析,他们认为属于分子晶体的是( )
A.NaCl、MgCl2、CaCl2
B.AlCl3、SiCl4
C.NaCl、CaCl2
D.NaCl、MgCl2、AlCl3、SiCl4、CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
II.海藻中提取碘的流程如图所示
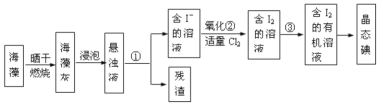
(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有______
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(2)指出提取碘的过程中有关实验操作名称:①________③__________④_________
(3)步骤②反应的离子方程式为___________________,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________
(4)下列关于海藻提取碘的说法,正确的是_________
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。A是由两种元素组成的难溶于水的物质,两种元素的质量比为7:4;B是强酸;C的摩尔质量为34g·mol-1; F是最常见的无色液体;无色气体G能使品红溶液褪色;向含有I的溶液中滴加KSCN溶液,溶液出现血红色。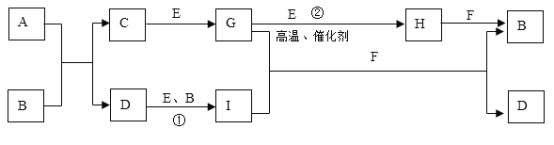
请回答下列问题:
(1)A的化学式____________________________。
(2)C的电子式____________________________。
(3)反应①的离子方程式_______________________________________________________。
(4)反应②的化学方程式_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量比为1:1的CO和H2组成的混合气体2.1 g在足量的氧气中点燃充分反应后,将产物立即通入足量的Na2O2固体中,固体质量增加为
A. 3.6 g B. 2.1g C. 7.2 g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A. BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. 常温下,0.1mol/L的HF溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
C. KHSO4在熔融状态下可导电:KHSO4=K++H++SO42-
D. 向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R2O8n-在一定条件下可以把 Mn2+氧化为 MnO4-,若反应后 R2O8n-变成 RO42-,又知反应中氧化剂与还原剂的物质的量之比为 5:2,则 R2O8n-中 R 元素的化合价为( )
A. +7 B. +6 C. +3 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中一定会产生误差的是
A.在中和热的测定实验中用Ba(OH)2代替NaOH,用H2SO4代替HCl
B.将pH试纸用蒸馏水润湿后测某溶液的pH
C.用碱石灰来干燥氨气
D.使用天平称量时误将药品与砝码的位置放反
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com