
【题目】分枝酶可用于生化研究,其结构简式如图。下列关于分枝酶的叙述正确的是
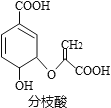
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解无关的是
A.Na2CO3、NaHCO3被视作“碱”用于面食制作
B.NaHSO4溶液显酸性
C.铝盐可用作净水剂
D.TiCl4溶液经蒸干、焙烧制得TiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。
已知在常温下:K(C6H5OH)=1.2×10-10 K(CH3COOH)=1.8×10-5
K(H2CO3)=4.3×10-7 K(HCO3-)=5.6×10-11 K(HCN)=4.9×10-10
(1)请根据上述信息求Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的化学平衡常数K=_________;
NaHCO3+C6H5ONa的化学平衡常数K=_________;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,则该电解质可能是____(填序号);
A. CuSO4
B. HCl
C. Na2S
D.NaOH
E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性
①浓度为1.0×l0-3mol.L-1的氨水bL;
②c(OH-)=1.0×10-3mol.L-l的氨水cL;
③c(OH-)=1.0×10-3molL-1的氢氧化钡溶液dL.
则a、b、c、d之间由大到小的关系是:_________;
(4)一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1_______n2(填“>”、“<”或“=”);
(5)己知常温时Ksp(AgCl)=1.8×10-10mol2L-2,向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,则c(Ag+)=_______,此时所得混合溶液的pH=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)化合物H是合成抗心律失常药物决奈达隆的一种中间体,可通过以下方法合成:
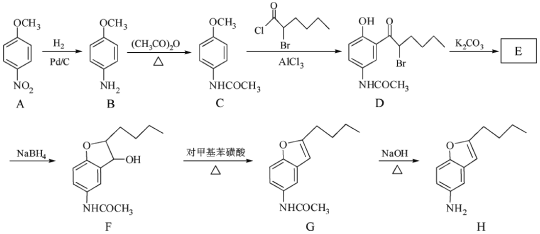
(1)D中的含氧官能团名称为____________(写两种)。
(2)F→G的反应类型为___________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式:___________。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化
②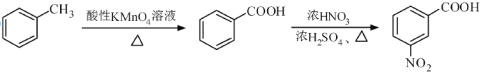
请以甲苯和(CH3CO)2O为原料制备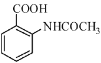 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届绵阳三诊】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是
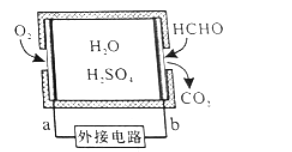
A.b为电池的负极,甲醛被氧化
B.a极的电极反应为O2+4e-+4H+==2H2O
C.传感器工作过程中,电解质溶液中硫酸的浓度不变
D.当电路中转移1×10-4 mol电子时,传感器内参加反应的HCHO为0.75 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物和探究溴乙烷的性质。已知:NaBr+H2SO4![]() NaHSO4+HBr↑
NaHSO4+HBr↑
(一)溴乙烷的制备及产物的检验:设计了下图装置,其中夹持仪器、加热仪器及冷水管没有画出。请根据实验步骤,回答下列问题:
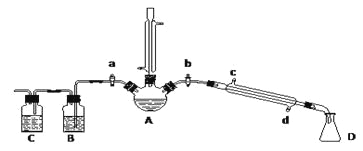
(1)制备操作中,加入少量的水,其目的是 (填字母)。
a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少HBr的挥发
d.水是反应的催化剂
(2)检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是 、 (填字母)。
a.苯 b.水 c.NaOH 溶液 d.硝酸银溶液
(3)欲除去溴乙烷中的少量杂质Br2,正确方法是 (填字母)。
a.KI溶液洗涤
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
(二)溴乙烷性质的探究:某同学用下图装置(铁架台、酒精灯等未画出)来探究溴乙烷的性质。在试管中加入10 mL 6molL-1NaOH水溶液和5 mL 溴乙烷,水浴加热。当观察到___________ 现象时,表明溴乙烷与NaOH水溶液已完全反应。该反应的化学方程式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中一定正确的是( )
A.Na2O2固体中阳离子与阴离子的个数比为1∶1
B.从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中
C.将Na投入饱和Na2CO3溶液中,会导致溶液质量增加
D.金属Na失火,可用CO2灭火
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com