国家环保总局“环境监测公报”中指出,减少SO2等有害气体的排放和生活废水的处理是我国“十一五”期间环境保护的主要任务.保护我们赖以生存的环境应该成为我们每个人的自觉行动.下面是一些有关大气污染及治理的问题,请回答相关的内容:
(1)分析某地几年内的降雨成分发现,前些年雨水中阴离子主要以SO2-4离子为主,近几年雨水中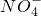 离子的比例有呈明显上升的趋势.通过该地的雨水样本分析,推测该地的大气污染特征是______.
离子的比例有呈明显上升的趋势.通过该地的雨水样本分析,推测该地的大气污染特征是______.
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)某校研究性学习小组收集到一酸雨样本,他们将样本置于敞口容器中并对样本进行一段时间的pH值测定,其测定结果见下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 | 6 | 6 |
| 样本的Ph | 4.93 | 4.72 | 4.63 | 4.58 | 4.56 | 4.55 | 4.55 |
请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______.
(3)在工业上采用氨法烟气脱硫技术.其做法是用氨吸收烟气中的SO
2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO
2后的混合手中通入适量的氨气得到一种复合肥.氨水吸收SO
2生成亚硫酸铵的化学方程式______.
(4)为将SO
2的污染变废为宝,人们正在探索用CO还原SO
2得到单质硫的方法来除去SO
2和得到单质硫.该方法涉及到的化学反应有:
A.XSO
2+2XCO═2xCO
2+S
xB.xCO+S
x═xCOS
C.2XCOS+xSO
2═2xCO
2+3S
x其中属于氧化还原反应的是______(填字母).COS分子的电子式为______.
(5)含氮氧化物的气体可以用NH
3在一定条件下进行处理,变成两种无毒的物质后排放.下列流程是探究不同催化剂对NH
3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).为比较不同催化剂的催化性能,需要测量并记录的数据是______.在催化剂存在下NH
3还原NO的化学方程式______.

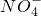 离子的比例有呈明显上升的趋势.通过该地的雨水样本分析,推测该地的大气污染特征是______.
离子的比例有呈明显上升的趋势.通过该地的雨水样本分析,推测该地的大气污染特征是______.
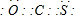 ,故答案为:
,故答案为: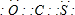 ;
; 5N2+6H2O,
5N2+6H2O, 5N2+6H2O;
5N2+6H2O;

 名校课堂系列答案
名校课堂系列答案