
【题目】下列溶液不能与Ba(OH)2反应的是( )
A. 氯化钠溶液B. 硫酸铜溶液
C. 硝酸铁溶液D. 氯化铵溶液
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水;草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是____________,由此可知草酸晶体分解的产物中有_______。

装置B的主要作用是__________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。


①乙组的实验装置中,依次连接的合理顺序为A→B→____→______→______→______→______→I。装置H反应管中盛有的物质是_________;I中集气瓶收集到的气体主要是_________。
②能证明草酸晶体分解产物中有CO的现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一组是

选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-=O2↑+2H2O |
C | 负极 | CuCl2溶液 | b管中有气体逸出 |
D | 负极 | NaOH溶液 | 溶液PH降低 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪90年代初,国际上提出“预防污染”这一新概念,绿色化学是预防污染的基本手段,下列各项属于绿色化学的是
A.减少有毒物B.治理污染点C.处理废弃物D.杜绝污染源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)质量数为37的氯原子符号为_______。
(2)S2-的结构示意图为______。
(3)氮原子的电子式为______,N2的电子式为______,NH4+的电子式为_________
(4)磷原子的核外电子排布式为______,其价电子排布式为_____, 其价电子排布图为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
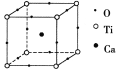
(1)在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的钛离子、钙离子各有__________个、__________个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构如图中正方体边长(钛原子之间的距离)为d nm(1 nm=1×10-9 m),则该晶体的密度为__________g/cm3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。

(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______。
(3)一个晶胞的体积是多少?
(4)金晶体的密度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJmol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=___kJmol-1。
(2)利用氧化氮氧化物的流程如下:
![]()
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,
若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________(填“增大”、“减小”或“不变”);试计算溶液中c(SO32-)/c(HSO3-)=_______。(常温下H2SO3的电离常数:Ka1=1×10-2 mol/L,Ka2=6.0×10-8mol/L)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol·L-1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入________;为确保溶液中不出现浑浊,应调节溶液的pH不超过______。(常温下,Ksp[Fe(OH)2]=1.8×10-16)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com