


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
[化学—选修化学与技术]
H2O2的水溶液是一种常用的杀菌剂。
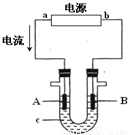
(1)H2O2旧的工业制法是以Pt为阳极、石墨为阴极电解硫酸氢铵溶液,再将电解产物水解。化学方程式为:
![]() 。写出电解硫酸氢铵溶液的阴极和阳极反应工。
。写出电解硫酸氢铵溶液的阴极和阳极反应工。
阴极: ;
阳极: ;
(2)H2O2新的工业制法是先将乙基蒽醌加氢还原,再将中间产物去氢氧化即得H2O2,反应方程式为

乙基蒽醌在此变化过程中的作用以及与旧的工业制法相比新工业制法的优点是
。
(3)H2O2的实验室制法之一是将过氧化钡加入到稀硫酸中,该反应的化学方程式为
(4)写出一种定量测定H2O2水溶液中H2O2含量的化学方程式
(5)写出符合(4)反应原理的简要实验步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修化学与技术](15分)
H2O2的水溶液是一种常用的杀菌剂。
(1)H2O2旧的工业制法是以Pt为阳极、石墨为阴极电解硫酸氢铵溶液,再将电解产物水解。化学方程式为:
![]() 。写出电解硫酸氢铵溶液的阴极和阳极反应工。
。写出电解硫酸氢铵溶液的阴极和阳极反应工。
阴极: ;
阳极: ;
(2)H2O2新的工业制法是先将乙基蒽醌加氢还原,再将中间产物去氢氧化即得H2O2,反应方程式为
乙基蒽醌在此变化过程中的作用以及与旧的工业制法相比新工业制法的优点是
。
(3)H2O2的实验室制法之一是将过氧化钡加入到稀硫酸中,该反应的化学方程式为
(4)写出一种定量测定H2O2水溶液中H2O2含量的化学方程式
(5)写出符合(4)反应原理的简要实验步骤
查看答案和解析>>
科目:高中化学 来源:哈师大附中、东北师大附中、辽宁省2010年高三第二次联考(理综)化学部分 题型:填空题
[化学—选修化学与技术] (15分)
H2O2的水溶液是一种常用的杀菌剂。
(1)H2O2旧的工业制法是以Pt为阳极、石墨为阴极电解硫酸氢铵溶液,再将电解产物水解。化学方程式为:
 。写出电解硫酸氢铵溶液的阴极和阳极反应工。
。写出电解硫酸氢铵溶液的阴极和阳极反应工。
阴极: ;
阳极: ;
(2)H2O2新的工业制法是先将乙基蒽醌加氢还原,再将中间产物去氢氧化即得H2O2,反应方程式为

乙基蒽醌在此变化过程中的作用以及与旧的工业制法相比新工业制法的优点是
。
(3)H2O2的实验室制法之一是将过氧化钡加入到稀硫酸中,该反应的化学方程式为
(4)写出一种定量测定H2O2水溶液中H2O2含量的化学方程式
(5)写出符合(4)反应原理的简要实验步骤
查看答案和解析>>
科目:高中化学 来源:四川省模拟题 题型:填空题
 2NH3(g);△H= -92.4 kJ/mol,
2NH3(g);△H= -92.4 kJ/mol,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com