
已知反应 A + 3B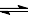 2C + D 在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L.min),则此段时间内以B浓度变化表示的化学反应速率为( )
2C + D 在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L.min),则此段时间内以B浓度变化表示的化学反应速率为( )
A. 0.5 mol/(L.min) B. 1 mol/(L.min)
C. 2 mol/(L.min) D. 3 mol/(L.min)
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关叙述正确的是
A. 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B. 同体积、同密度的C2H4和CO,两种气体的分子数一定相等
C. 配制450 mL 0.1 mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g
D. 1 L 0.45 mol·L-1NaCl溶液中Cl-的物质的量浓度比0.1L 0.15 mol·L-1AlCl3溶液大
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
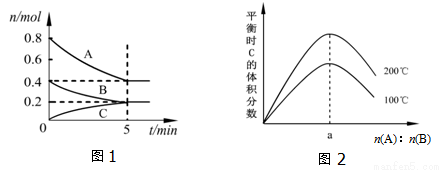
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L﹣1•min﹣1
B. 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=1
C. 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆
D. 200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_____________ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________ (选填“酸性”“中性”或“碱性”),理由是__________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为_____________________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应 ≥____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )
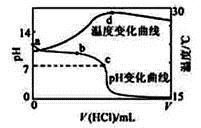
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O) > c(Cl-)
C. c点:反应消耗的HCl 和NH3·H2O 的关系为:n(HCl)= n(NH3·H2O)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:简答题
(1)有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。回答下列问题
①CO 移向____________极。
移向____________极。
②正极反应式为____________________。
③电池中CO 的物质的量将逐渐________________(填增大、减少、不变)。
的物质的量将逐渐________________(填增大、减少、不变)。
(2)用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则

①电源A极是______________极。
②c极上的电极反应式:___________________。
③甲、乙两池共可收集到________mol气体。
④丙装置上某极可析出固体________克,溶液的pH为________________。(常温,不考虑溶液体积变化)
⑤电解n分钟后,硫酸铜正好消耗完,再将e、f电极反接电源,用同样的电流再电解n分钟,则丙溶液中的硫酸铜的物质的量浓度为______________mol/L。(不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
用图甲装置电解一定量的CuSO4溶液,M、N为惰性电极。电解过程实验数据如图乙所示。X轴表示电解过程中转移电子的物质的量,Y轴表示电解过程产生气体的总体积。则下列说法不正确的是

A. A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态
B. 电解过程中N电极表面先有红色物质生成,后有气泡产生
C. Q点时M、N两电极上产生的气体总量在相同条件下体积相同
D. 若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
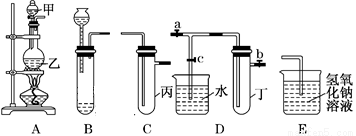
(1)实验室用装置A来制取Cl2,反应的离子方程式是______________;若将装置B、C、E相连后,用浓盐酸和______(填下列试剂的标号)为原料可制取Cl2。
a.KMnO4固体 b.KClO3固体 c.KCl固体 d.浓硫酸
(2)用装置B来制取制取氯气,并将装置B、C、E相连,在丙中加入适量水,即可制得氯水。向该氯水中加入大理石,充分振荡,观察到氯水的黄绿色逐渐褪去,同时产生少量气泡。某同学根据此现象推断出氯水呈酸性,请问该同学的推断是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,此空无需填写):_________________。
(3)为了探究氯水与大理石的反应,用装置A来制取氯气,并依次连接装置A、C、C、E。在第一个装置C的丙中,应加入的试剂是____________;在第二个装置C的丙中,加入适量水,即制得氯水。向制得的氯水中加入过量的大理石,反应结束后将所得溶液分成四等分,进行I、Ⅱ、Ⅲ、Ⅳ四个实验,实验操作如下,将实验现象或者实验结论填入下表:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将该溶液滴在有色布条上 | 有色布条迅速褪色 | ①该溶液中含有__________ |
Ⅱ | 向该溶液中滴加碳酸钠溶液 | ②___________ | 该溶液中含有Ca2+ |
Ⅲ | 向该溶液中滴加稀盐酸 | 有无色气泡产生 | ③无色气体是____________ |
Ⅳ | 加热该溶液 | 溶液变浑浊并产生大量气体 | ④该溶液中含有__________ |
⑤通过上述实验,得出氯水和过量的大理石反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:实验题
锰的化合物种类较多,大多具有广泛的用途。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是__________(填序号)。
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
试管编号 | 实验现象 |
A | 溶液不变色 |
B | 溶液缓慢变浅棕褐色 |
C | 溶液迅速变棕褐色 |
①从以上实验中,我们可以得出的结论是_____________________。
②写出C试管中发生反应的离子方程式:_______________________。
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:

已知:Fe3+、Mn2+沉淀的pH如表格所示。
开始沉淀 | 完全沉淀 | |
Fe3+ | 2.7 | 4.2 |
Mn2+ | 8.3 | 10.4 |
步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_________________。
步骤二中需控制pH的范围是_________________。
步骤三中是否洗涤干净的判断方法是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com