
����ZnO�������ϡ�Ϳ�Ϲ�ҵ������ҪӦ�ã�һ���ɴ�ZnO����FeO��CuO���Ʊ�����ZnO���������£���֪����ʽ̼��п�����տ��Ƶû���ZnO����

��֪�������������������������ʱ��pH���±���
| ���������� | Fe2�� | Fe3�� | Zn2�� | Cu2�� |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
���ʴ��������⣺
�� ����A��H2O2������Ӧ�����ӷ���ʽ�� �� ���ò����������ҺpH�ķ�Χ�� �� ��
�� A��Һ����Ҫ���е������� �� ��
�� ��ʽ̼��п�������Ƶû���ZnO�ķ�Ӧ��H��0���÷�Ӧ���Է����е�ԭ���ǡ�H �� ��ѡ�=��������������������0��
�� ����������ķ�ˮpH��8����ʱZn2����Ũ��Ϊ �� mg/L�������£�Ksp[Zn(OH)2]��1.2��10-17����
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
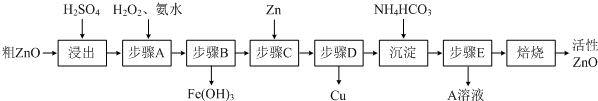
| ���������� | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
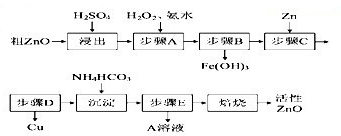
| ���������� | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
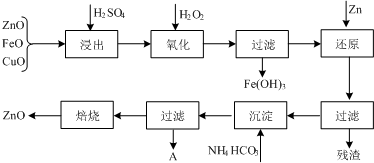
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���������� | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�����ѧ����10�½���ϰ��ѧ�Ծ����������� ���ͣ������
��15�֣�����ZnO�������ϡ�Ϳ�Ϲ�ҵ������ҪӦ�ã�һ���ɴ�ZnO����FeO��CuO���Ʊ�����ZnO���������£���֪����ʽ̼��п�����տ��Ƶû���ZnO����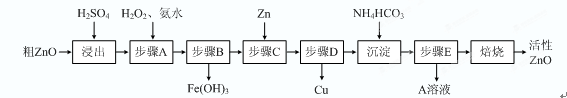
��֪�������������������������ʱ��pH���±���
| ���������� | Fe2�� | Fe3�� | Zn2�� | Cu2�� |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com