
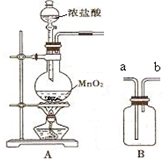
 实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题:
实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题:| 实验目标 | 装填试剂 (填选项字母) | 气体流向 (填a、b) |
| 除去HCl杂质 | E | a→b |
| 干燥氯气 | C | a→b |
| 收集氯气 | D | |
| 检验氯气的氧化性 | F |
| ||
| 实验目标 | 装填试剂(填选项字母) | 气体流向(填a、b) |
| 除去HCl杂质 | __D | a→b |
| 干燥氯气 | __A | a→b |
| 收集氯气 | ___b__→__a | |
| 检验氯气的氧化性 | ___a__→__b |
| ||
| m |
| M |
| 10.95g |
| 36.5g/mol |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
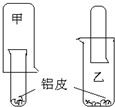 为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.
为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.查看答案和解析>>
科目:高中化学 来源: 题型:
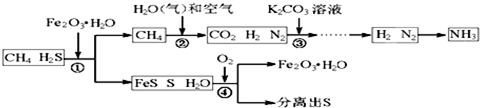
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol |
| B、1.2 mol |
| C、0.1mol |
| D、1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以O2浓度变化表示的反应速率为0.064 mol?(L?s)-1 | ||
| B、反应达到平衡状态时NH3的转化率为20% | ||
C、升高温度能使
| ||
| D、将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应准确称取氢氧化钠固体19.2g |
| B、为了减少损失,将氢氧化钠固体直接倒入容量瓶中,加水溶解 |
| C、定容时仰视读数,所配制的溶液浓度会偏低 |
| D、摇匀后溶液液面低于刻度线,应补充适量蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
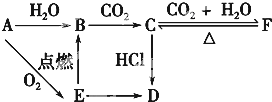
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com