
常温下,下列不发生反应的一组物质是( )
①铜与浓硫酸
②二氧化硅与NaOH溶液
③铜与浓硝酸
④石英与纯碱
⑤铁与液氯
⑥一氧化氮与氧气
⑦硅与氧气
⑧H2S与SO2.
|
| A. | ①②③⑥ | B. | ②③⑥⑧ | C. | ①④⑤⑦ | D. | ①②③⑦ |
考点:
浓硫酸的性质;氯气的化学性质;硝酸的化学性质;氮的氧化物的性质及其对环境的影响;二氧化硫的化学性质;硅和二氧化硅.
专题:
元素及其化合物.
分析:
①常温下,铜与浓硫酸不反应,但加热条件下发生氧化还原反应;
②二氧化硅与NaOH溶液反应生成硅酸钠和水;
③铜与浓硝酸发生氧化还原反应生成硝酸铜、二氧化氮和水;
④石英与纯碱在高温条件下反应生成硅酸钠和二氧化碳;
⑤铁与液氯不反应;
⑥一氧化氮与氧气生成二氧化氮;
⑦硅与氧气常温下不反应;
⑧H2S与SO2常温下反应生成S单质.
解答:
解:①常温下,铜与浓硫酸不反应,但加热条件下发生氧化还原反应,Cu+2H2SO4 CuSO4+SO2↑+2H2O,故选;
CuSO4+SO2↑+2H2O,故选;
②二氧化硅与NaOH溶液反应生成硅酸钠和水,反应方程式为2NaOH+SiO2=Na2SiO3+H2O,故不选;
③铜与浓硝酸发生氧化还原反应生成硝酸铜、二氧化氮和水,Cu+4HNO3=Cu(NO3)2+2NO2+2H2O,故不选;
④石英与纯碱在高温条件下反应生成硅酸钠和二氧化碳,SiO2+Na2CO3 NaSiO3+CO2↑,故选;
NaSiO3+CO2↑,故选;
⑤铁与液氯不反应,2Fe+3Cl2 2FeCl3,故选;
2FeCl3,故选;
⑥一氧化氮与氧气生成二氧化氮,2NO+O2=2NO2,故不选;
⑦硅与氧气常温下不反应,故选;
⑧H2S与SO2常温下反应生成S单质,2H2S+SO2=3S+2H2O,故不选;
故选C.
点评:
本题考查了物质之间的反应,明确物质的性质是解本题关键,有些反应常温下不能反应,但在点燃或高温下反应,题目难度不大.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
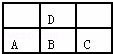
|
| A. | D与C不能形成化合物 |
|
| B. | D的最高正价与B的最高正价相等 |
|
| C. | A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A |
|
| D. | A、B、C、D原子所具有的原子轨道类型和数目都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是硫酸试剂瓶标签上的内容:
(1).则该硫酸的物质的量浓度为 mol•L﹣1.
(2).某化学兴趣小组进行硫酸性质的实验探究时,需要240mL 4.6mol•L﹣1的稀H2SO4,现取上述浓硫酸稀释配制稀硫酸,则所需实验仪器有 ,所需量取 mL的该硫酸.
(3)下面是某学生的操作过程:
a.将浓硫酸倒入另一个盛有适量蒸馏水的烧杯中稀释,并冷却到室温;
b.用量筒量取浓硫酸;
c.用玻璃棒引流,将稀释后的硫酸倒入已检查不漏水的容量瓶中;
d.将所得溶液倒入试剂瓶,在试剂瓶上贴上标签待用.
e.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
f.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1cm~2cm
g.洗涤烧杯和玻璃棒,并将洗涤液注入容量瓶.
正确的操作顺序是 .(用字母表示)
(4)在配制4.6mol•L﹣1的稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中: ;
②容量瓶用1mol•L﹣1的稀H2SO4润洗: ;
③定容时仰视液面读数: .
④容量瓶有蒸馏水 .

查看答案和解析>>
科目:高中化学 来源: 题型:
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:

下列说法正确的是( )
|
| A. | 维生素C的分子式为C6H8O6 |
|
| B. | 维生素C在酸性条件下水解得到3种产物 |
|
| C. | 维生素C不溶于水,可溶于有机溶剂 |
|
| D. | 上述反应为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
|
| A. | 合金的熔点一般比组成合金的各成分金属高 |
|
| B. | 我国规定商家不得无偿提供塑料袋,目的是降低成本 |
|
| C. | 红宝石、蓝宝石和金刚石都是由碳元素组成的宝石 |
|
| D. | 氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素及其化合物性质的比较正确的是( )
|
| A. | 原子半径:F<O<Al | B. | 稳定性:H2O<PH3<NH3 |
|
| C. | 酸性:H2CO3<H2SO4<H3PO4 | D. | 碱性:LiOH<NaOH<Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
阴离子Xn﹣含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。根据要求回答下列问题:
(1)基态Ni的价电子构型(电子排布式)为______________________。
(2)Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂,则Ni(CO)4属于_______晶体。
(3) 可与丁二酮肟(
可与丁二酮肟(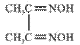 )作用生成腥红色配合物沉淀A。
)作用生成腥红色配合物沉淀A。
①丁二酮肟分子中碳原子的杂化轨道类型有______________,1mol该分子中含有的碳碳σ键和碳氮σ键的总数为__________。
②氨气在水中的溶解度远大于甲烷,其原因是____________。
③腥红色配合物沉淀A中(结构如下)除含有一般共价键外,还含有配位键和氢键,请在下图中标出配位键和氢键。

(提示: 的配位数为4,配位键用“→”表示,氢键用“…”表示)
的配位数为4,配位键用“→”表示,氢键用“…”表示)
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,该新型超导晶体的一个晶胞的结构如下图所示,则该晶体的化学式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,往容积恒定的密闭容器中投入2molA和1molB,发生可逆反应:2A(g)+B(g)⇌C(g)+D(s),达到平衡时,测得压强为原压强的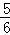 ,则A的转化率为( )
,则A的转化率为( )
|
| A. | 25% | B. | 40% | C. | 50% | D. | 75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com