
【题目】目前大多数城市采用雨污分流的排水体制,污水汇集到一起,进行集中处理。如图是电解法处理某生活污水的装置:

下列叙述正确的是( )
A.甲、乙两个电极均为消耗型电极,不能用石墨代替
B.电解开始时,阴极反应为2H2O+2e-=H2↑+2OH-,阴极区pH升高
C.当阳极有9.0gAl溶解时,阴极一定增重100.5g或32.0g
D.污水中污染物的除去是阳极反应与阴极反应协同作用的结果
【答案】D
【解析】
A.电极乙为阴极,在电解过程中不消耗,可以用石墨电极代替,故A错误;
B.根据图示可知污水中含Cu2+、Hg2+,故电解开始阶段阴极的电极反应依次为Hg2++2e-=Hg、Cu2++2e-=Cu,故B错误;
C.已知信息中没有确定污水中Cu2+、Hg2+的量,故不能确定在电解时阴极生成物的质量,故C错误;
D.污水中的Cu2+、Hg2+在阴极还原析出,阳极Al失电子生成Al3+,与后续阴极反应(2H2O+2e-=H2↑+2OH-)生成的OH-生成具有吸附作用的Al(OH)3胶体,吸附污水中的污染物,同时生成的H2所产生的微小气泡起到气浮的作用,使密度较小的絮状物上浮到水面,故D正确;
故答案为D。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】一种以NH4Cl酸性蚀铜废液[含NH4Cl、Cu(NH3)4Cl2、CuCl、CuSO4及盐酸等]为原料制备CuCl并回收Cu(OH)2的工艺流程如图:
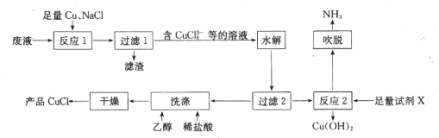
回答下列问题:
(1)“反应1”中,NaCl、Cu、CuSO4反应的离子方程式为____;生产中常将“过滤1”的滤渣返回到“反应1”中,其目的是______。
(2)“水解”步骤中,加入大量水稀释即可析出CuCl,原因是 ____________(结合离子方程式,从平衡角度分析)。
(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,该反应的化学方程式为____;“洗涤”时稀盐酸和乙醇洗涤的目的是______________ 。
(4)“反应2”需加入的试剂X是 ___;“吹脱”出来的NH3可用于生产碳铵化肥,主要反应的化学方程式为 ______ 。
(5)测定产品中CuCl质量分数的步骤如下:称取ag产品,加入稍过量的FeCl3溶液,待溶解后用邻非罗啉作指示剂,立刻用c mol/L的Ce(SO4)2标准溶液滴定到终点,消耗标准溶液VmL。则产品中CuCl的质量分数为____(已知滴定反应为 Ce4++Fe2+=Ce3++Fe3+,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物说法不正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.萘环![]() 上的一个H原子被一C4H9取代后的产物共有8种
上的一个H原子被一C4H9取代后的产物共有8种
C.对甲基苯乙烯中最多有17个原子共面
D.立方烷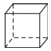 一氯代物1种、二氯代物有3种、三氯代物也有3种
一氯代物1种、二氯代物有3种、三氯代物也有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用付-克反应可制备芳香族化合物,如:![]() +C4H9Cl
+C4H9Cl![]() +HCl↑。下列有关说法不正确的是
+HCl↑。下列有关说法不正确的是
A.该反应为取代反应
B.![]() 属于烃的衍生物
属于烃的衍生物
C.分子式为C4H9Cl的物质有4种
D.![]() 能发生加成反应
能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组的同学在实验室利用现代先进仪器,获得了某有机物R的相关图谱如下:
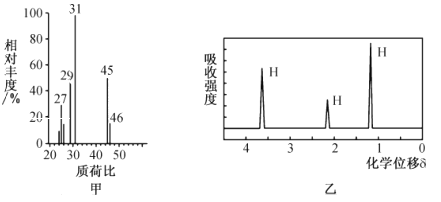
回答下列问题:
(1)上图中,甲为_____图,获得该图谱所使用的仪器名称为_______;乙为_____图,获得该图谱所使用的仪器名称为__________________。
(2)已知R属于醇类物质
①结合图谱信息可推知R为 ___________(写名称),写出其与金属钠反应的化学方程式:________________。
②该有机物R_______(填“有”或“无”)同分异构体(不考虑立体结构),若有,请写出其同分异构体的结构简式:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物M是一种治疗恶性肿瘤的合成药物。制备M的一种合成路线如图所示:
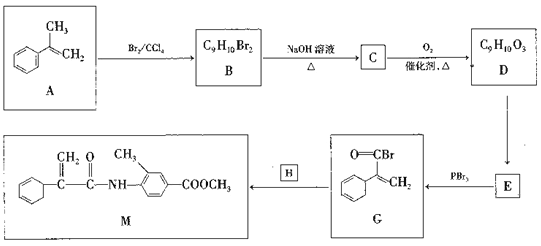
已知: 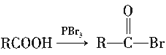 (R为烃基)。
(R为烃基)。
(1)A的化学名称是________。
(2)由A生成B和B生成C的反应类型分别是_________、________。
(3)由C生成D的化学方程式是____________________。
(4)写出E的结构简式:________,X是E的同分异构体,且X满足下列条件:
①能发生银镜反应;②遇浓FeCl3溶液变色;③分子结构中只含一个碳环结构。
符合上述条件的X有_____种,其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1的结构简式是_____________。
(5)根据题给信息,写出用CH3CHO和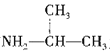 为原料制备
为原料制备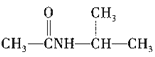 的合成路线:_________________(其他试剂任选)。
的合成路线:_________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+O2(g)=CO2(g)△H1
②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3
④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。请回答下列问题:
(1)已知:①C2H6 (g)![]() C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
②H2 (g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol
③ C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
则表征 C2H6 (g)燃烧热的热化学方程式为_____。
(2)1000℃时,在某刚性容器内充入一定量的 C2H6 ,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙 烷的平衡转化率为 40%。
①乙烷分解前容器压强为_____Pa ,1000℃时,反应①的平衡常数 Kp=_____Pa[气体分压(P 分)=气体 总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_____40%(填“>”、“<” 或“=”)。
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
① 反应 C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
② 800℃时,控制原料气的总物质的量一定,当 C2H6 和 O2 的物质的量之比为 2:1 时,乙烯的平衡产率最大,而当![]() 较小时,乙烯的平衡产率较低,可能的原因为_____。
较小时,乙烯的平衡产率较低,可能的原因为_____。
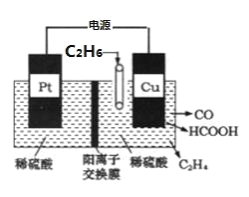
(4)利用电解法可将 C2H6 转化为多种燃料,原理如图所示。铜电极为_____极,该电极上生成 HCOOH 的电极反 应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com