
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
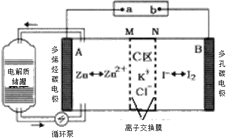
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
【答案】D
【解析】
由装置图可知,放电时,A极:Zn是负极,电极反应式为Zn-2e-═Zn2+,B极:石墨是正极,电极反应式为I2+2e-=2I-,据此分析解答。
A. 放电时,A极:Zn是负极,电极反应式为Zn-2e-═Zn2+,故A正确;
B. 放电时,B极是正极,故充电时,B极相当于电解池的阳极,与外接电源正极相连,故B正确;
C. 放电时,A极是负极,电极反应式为Zn-2e-═Zn2+,所以储罐中的离子总浓度增大,故C正确;
D. 放电时,A极电极反应式为Zn-2e-═Zn2+,A极减小65g,即1mol锌,则负极区生成1mol Zn2+、正电荷增加,M为阴离子交换膜,所以会有2molCl通过M膜进入负极,所以C区Cl﹣减少2NA,故D错误;
答案选D。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在2L恒容的密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。据图回答:

(1)该反应的化学方程式可表示为_______________________________________________。
(2)反应起始至t min(设t=5),X的平均反应速率是________________。
(3)在t min时,该反应达到了____________状态,下列可判断反应已达到该状态的是________(填字母,下同)。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2∶3
C.混合气体的密度不变 D.生成1molZ的同时生成2molX
(4)从开始到t秒末X的转化率__________。
(5)用一定能使该反应的反应速率增大的措施有________。
A.其他条件不变,及时分离出产物 B.适当降低温度
C.其他条件不变,增大X的浓度 D.保持体积不变,充入Ar气使容器内压强增大
(6)在一个体积固定的密闭容器中,进行的可逆反应A(s)+3B(g) ![]() 3C (g)。下列叙述中表明可逆反应一定达到平衡状态的是 __________
3C (g)。下列叙述中表明可逆反应一定达到平衡状态的是 __________
①C的生成速率与C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③B的浓度不再变化;
④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1∶3∶3;
⑥混合气体的密度不再变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的反应方程式为![]() (x<1)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸的装置如图所示(苯甲酸盐溶液酸化后可以析出苯甲酸)。下列说法正确的是
(x<1)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸的装置如图所示(苯甲酸盐溶液酸化后可以析出苯甲酸)。下列说法正确的是
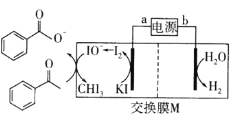
A.电池放电时,Li+向b极移动
B.电池充电时,a极反应式为LiCoO2-xe-=Lil-xCoO2+xLi+
C.M为阳离子交换膜
D.生成苯甲酸盐的反应为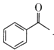 +3IO→
+3IO→![]() + CHI3+2OH-
+ CHI3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
A. 单位时间内生成n mol O2 的同时,生成2n molNO2 B. 混合气体的平均相对分子质量不再改变
C. 混合气体的颜色不再改变 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
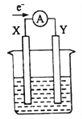
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】王浆酸是从蜂王浆中分离出的一种有机酸,它有很好的杀菌、抗癌、抗放射及强化机体、增强免疫力的作用,其结构如下所示。有关王浆酸的说法不正确的是( )
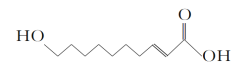
A. 分子式为C10H18O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下能发生取代反应和氧化反应
D. 1 mol王浆酸最多能中和2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 K 是某药物的中间体,合成路线如图所示:

已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列问题
(1)A 的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂 X是_____。
(5)E 属于烃,其结构简式是_____。
(6)H 中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H 经三步反应合成 K:H![]() I→J→K,写出中间产物 I和J的结构简式_____。
I→J→K,写出中间产物 I和J的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 加入少量盐酸D. 通入NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)CuSO4晶体中S原子的杂化方式为________,SO42-的立体构型为_______________。
(2)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
![]()
①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为__________________________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(3)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如下左图所示。
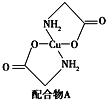
①1 mol氨基乙酸钠(H2NCH2COONa)含有σ键的数目为________________。
②氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
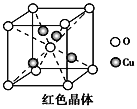
③已知:硫酸铜灼烧可以生成一种红色晶体,其结构如上右图所示。则该化合物的化学式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com