
����Ŀ���ڼס��ҡ���������ͬ�ܱ������а���ͬ��ʽͶ�ϣ�һ�������·�����Ӧ(��ʼ�¶Ⱥ���ʼ�����ͬ):N2(g)+3H2(g)![]() 2NH3(g) ��H<0������������±���ʾ:
2NH3(g) ��H<0������������±���ʾ:
���� | �� | �� | �� |
������� | ���º��� | ���Ⱥ��� | ���º�ѹ |
��Ӧ��Ͷ�� | lmolN2��3molH2 | 2molNH3 | 2molNH3 |
ƽ��ʱ������� | V�� | V�� | V�� |
��Ӧ��ƽ�ⳣ��K | K�� | K�� | K�� |
ƽ��ʱNH3��Ũ��/mol/L | c�� | c�� | c�� |
ƽ��ʱNH3�ķ�Ӧ����/mol/(L��min) | v�� | v�� | v�� |
����˵����ȷ����
A. V��>V�� B. K��>K�� C. c��>c�� D. V��=V��
���𰸡�BC
�����������ס��ҡ������Ǻ��º����������ҡ�������ʼ�����2molNH3���ü�����һ�ߵ��������Ϊ1molN2��3molH2������ж�Ӧ��ȣ���ﵽƽ��ʱ�ס��ҡ�������ȫȫ�ȵĵ�Чƽ�⡣A�����÷�Ӧ������Ӧ�������������С�ķ�Ӧ����Ϊ���º�ѹ��������ƽ�⣬������������V��![]() V��������B��÷�Ӧ������ӦΪ���ȷ�Ӧ����Ϊ���Ⱥ�����������ƽ�⣬�����¶Ƚ��ͣ������¶�ƽ��������Ӧ�����ƶ���Kֵ����K��
V��������B��÷�Ӧ������ӦΪ���ȷ�Ӧ����Ϊ���Ⱥ�����������ƽ�⣬�����¶Ƚ��ͣ������¶�ƽ��������Ӧ�����ƶ���Kֵ����K��![]() K������ȷ��C��÷�Ӧ������ӦΪ���ȷ�Ӧ����Ϊ���Ⱥ�����������ƽ�⣬�����¶Ƚ��ͣ����൱���ڼ״ﵽƽ��ʱ�����¶ȣ�ƽ��������Ӧ�����ƶ�����c��
K������ȷ��C��÷�Ӧ������ӦΪ���ȷ�Ӧ����Ϊ���Ⱥ�����������ƽ�⣬�����¶Ƚ��ͣ����൱���ڼ״ﵽƽ��ʱ�����¶ȣ�ƽ��������Ӧ�����ƶ�����c��![]() c������ȷ��D��÷�Ӧ������Ӧ�������������С�ķ�Ӧ����Ϊ���º�ѹ��������ƽ�⣬������������V��
c������ȷ��D��÷�Ӧ������Ӧ�������������С�ķ�Ӧ����Ϊ���º�ѹ��������ƽ�⣬������������V��![]() V��������ѡBC��
V��������ѡBC��


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�ij��������Ҿ�����ͬһ��Ԫ�أ�����֮���ת����ϵ����ͼ��ʾ(��Ӧ���������������Ѿ���ȥ)��
![]()
��1����A��һ�ֽ�����C�ǵ���ɫ���壬д��C��һ����;_______��
��2����AΪ����ɫ���嵥�ʣ�д��D��Ũ��Һ��ͭ��Ӧ�Ļ�ѧ����ʽ______��
��3����A�ǻ����C�Ǻ���ɫ���壬��A�Ļ�ѧʽΪ_____________��Cת��ΪD�Ĺ����У��������뻹ԭ����������Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������λ��ѧ���У��������ԭ���к˽ṹģ�͵���
A.¬ɪ��B.����C.��ķ��D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ����ģ��ش����⡣
��������Ȼ������������������ú��ӵ�������Ҫ�ɷ֣�����20%����Դ���������ṩ��
��������Ҫ�Ĺ�ҵԭ�ϡ�������·ֽ�ɵ�̿�ڣ����������ϡ���ī�������Լ������Ӽ������黹����Ȳ�������ἰ��ȩ����Ҫ�����Ʊ���ԭ�ϣ����黹������ȡ�ȷ£����ȼ��飩�����Ȼ�̼���л��ܼ���
��Ȼ���г������⣬�������������顢����Ͷ��飬�������⡢������̼��������ˮ��������һ����̼�ȡ������׳ơ�����������2008�걱���������ƻ������ñ�����Ϊȼ�ϵġ�����۸��������ȼ�¶ȷ�Χ����ȼ�ջ��������ɫ��ʶ��ȼ�ղ�������Ⱦ������һ�����ȼ�ϣ��ر���ϡ���ɫ���ˡ��������Ȼ������һ�ֳɷֶ���Ҳ����Ҫ��;���������䶳�����������ȼ�ϣ�Ҳ����ȡ�����л������Ҫԭ�ϡ�
Ŀǰ�������ҹ�ũ��Ҳ���Ź㷺��Ӧ�á�������һ�����¶ȡ�ʪ�ȡ�pH�����£����ոѡ��Ӳݡ�������ȶѻ��ڷ��ͳ��У��������������Ͳ��������������ҹ�ũ��ͨ���������أ����������˸�Ч���ȼ�ϣ�������ũ���ס���������ҷ��ͳ��л����Բ���������Һ����ϣ�һ�ٶ�á�
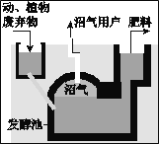
��1����Ȼ���г��������⣬������______________________________________���л��
��2��������·ֽ�õ�̿�ڵĻ�ѧ����ʽ��______________________________________��
��3���ȷµĽṹʽ��______________________________��
��4���������˻��ѡ�����������ȼ�ϵ�ԭ����______________������ţ���
a����ȼ�¶ȷ�Χ�� b���۸����
c��ȼ�ղ���û����Ⱦ d��ȼ�յĻ�����ɫ��ʶ��
��5����������������һ������Ļ�ѧ����ʽ��____________________________________��
��6������˵����ȷ����______________������ţ���
a��ú��ӵ����Ͻ�����
b������������������ȼ��
c�����ͳ���ֻ��������
d�����ͳ��п����õ�ԭ���нոѡ��Ӳݡ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������е����ʣ������ڵ����ʣ�����ʹ�õ��Լ�����Ҫ��������ȷ���ǣ�������
ѡ�� | ���� | ʹ�õ��Լ� | ��Ҫ���� |
A | �Ҵ���ˮ�� | ������ | ���� |
B | �������������ᣩ | ����̼������Һ | ��Һ |
C | �������ӣ� | Ũ��ˮ | ���� |
D | ���飨��ϩ�� | ���Ը��������Һ | ϴ�� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݡ��ο���Ϣ���������п�ѧ��������ǡ�21���͵���Դ������δ����ʯ�͡��Ĺ۵㣨1���������������ȼ�յ��Ȼ�ѧ����ʽΪSi��s��+O2��g���TSiO2��s����H=��989.2kJmol��1 �� �йؼ������������
��ѧ�� | Si��O | O�TO | Si��Si |
����/kJmol��1 | x | 498.8 | 176 |
��1����֪1mol Si�к�2mol Si��Si����1mol SiO2�к�4mol Si��O������x��ֵΪ
��2���������Ϊ��Դ�ѹ㷺Ӧ�����������ǡ���������������վ�ȣ��������һ�ְ� ��ת��Ϊ �ܵ�װ�ã�
��3���������Ϊһ���ձ�ʹ�õ�������Դ���������ã��������������ص�����˵���У�����Ϊ�������� ������ĸ����
A����������䡢���棬�Ӱ�ȫ�Ƕȿ��ǣ�������ѵ�ȼ��
B�������Դ�ḻ�����ڿ��ɣ��ҿ�����
C����ȼ�շų�����������ȼ�ղ���Ի�����Ⱦ�̶ȵͣ�������Ч����
D��Ѱ�Ҹ�Ч�´�����ʹ����������ܺܵͣ��ǹ���Դ�������õĹؼ�����
��4����ҵ�Ʊ�����ķ�ӦΪ2H2��g��+SiCl4��g���TSi��s��+4HCl��g����H=+240.4kJmol��1 �� ���ɵ�HClͨ��100mL 1molL��1��NaOH��Һǡ�÷�Ӧ����Ӧ������ ������ա����ͷš���������Ϊ kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ���
A. MgCO3![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
B. NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
C. Cu2(OH)2CO3![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2
D. SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO4
(NH4)2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʡ����ص����ʵ���Ҫԭ�ϡ�
��1���ϳɰ���ӦN2(g) + 3H2(g)![]() 2NH3(g)��һ�����������Է����е�ԭ���� ���绯ѧ���Ǻϳɰ���һ���·�������ԭ����ͼ1��ʾ�������ĵ缫��Ӧʽ�� ��
2NH3(g)��һ�����������Է����е�ԭ���� ���绯ѧ���Ǻϳɰ���һ���·�������ԭ����ͼ1��ʾ�������ĵ缫��Ӧʽ�� ��

��2����̼��[n(NH3)/n(CO2)]�Ժϳ�����[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]��Ӱ�죬���º���ʱ���������ʵ���3 mol��NH3��CO2�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ2��ʾ��a��b�߷ֱ��ʾCO2��NH3��ת���ʱ仯��c�߱�ʾƽ����ϵ�����ص���������仯��[n(NH3)/ n(CO2)]= ʱ�����ز���������㣬ͼ��y= ����ȷ��0.01����
CO(NH2)2(g)+H2O(g)]��Ӱ�죬���º���ʱ���������ʵ���3 mol��NH3��CO2�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ2��ʾ��a��b�߷ֱ��ʾCO2��NH3��ת���ʱ仯��c�߱�ʾƽ����ϵ�����ص���������仯��[n(NH3)/ n(CO2)]= ʱ�����ز���������㣬ͼ��y= ����ȷ��0.01����
��3����ˮ�к���������Ĵ��������ж��֡�
��NaClO��Һ�ɽ���ˮ�е�NH4+ת��ΪN2�������������в���N20.672 L����״����������Ҫ����0.3mol��L-1��NaClO��Һ L��
��������������£�NH4+����������Ӧ��ת��ΪNO3-��������Ӧ�������仯��ͼ3��ʾ����1 mol NH4+(aq)ȫ����������NO3-(aq)ʱ�ų��������� kJ��

����H2����ԭ���ɽ���ˮ��NO3-��Ũ�ȣ��õ��IJ����ܲ������ѭ������Ӧ����Һ��pH ������������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����0.10molL��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬȡ20.00mL����ϡ������Һ������ƿ�У����μ�2��3�η�̪��ָʾ�����ظ������ζ�����2��3 �Σ���¼�������£�
��1��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ��� ��
A.�ζ�ǰƽ�Ӷ������յ����ʱ���Ӷ���
B.��ƿˮϴ��δ���ñ�������ϴ
C.��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������Һ��ϴ
D.��Һ©������ƿ��һ��
E.�ζ�ǰ���Ӷ������յ�ζ����Ӷ���
F.��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
��2�����ڴﵽ�ζ��յ�ʱ�����������һ��NaOH��Һ��һ����Һ���ԼΪ0.05mL��������ˮ��50mL��������Һ��PHΪ
��3����ͼ����20mL������������0.1mol/L NaOH��Һʱ����Һ��pH�仯ͼ���μ�NaOH��ҺΪ10mLʱ���û��Һ��PH= �� ����Lg����ʽ�������ø�NaOH��Һ�ζ�δ֪Ũ�ȵ�CH3COOH��Һ����Ӧǡ����ȫʱ��������������ȷ����
A����Һ�����ԣ���ѡ�ü��Ȼ��̪��ָʾ�� B����Һ�����ԣ�ֻ��ѡ��ʯ����ָʾ��
C����Һ�ʼ��ԣ���ѡ�ü��Ȼ��̪��ָʾ�� D����Һ�ʼ��ԣ�ֻ��ѡ�÷�̪��ָʾ��
��4��������ԭ�ζ�����ȡ������Һ������ƿ�У���������ϡ���ᣬ��Ũ��Ϊ0.1molL��1�ĸ��������Һ�ζ��������ķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O�������м�¼��ʵ�����ݣ�
�� | ����Һ��� | ��KMnO4��Һ�����mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 25.00 | 0.50 | 23.40 |
�ڶ��� | 25.00 | 4.00 | 23.90 |
������ | 25.00 | 5.00 | 25.10 |
�ٵζ�ʱ���ζ��յ�ʱ�ζ�������
�ڸò�����Һ�����ʵ���Ũ��Ϊ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com