
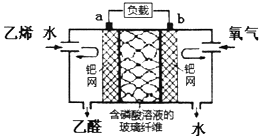
| A. | 该电化学装置是电解池 | |
| B. | a极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 氧气在b极被氧化 | |
| D. | 电子移动方向:电极a→负载→电极b→磷酸溶液→电极a |
分析 CH2=CH2被氧化,应为原电池的负极反应,因电解质溶液呈酸性,则负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,正极通入氧气,发生还原反应,电极方程式为O2+4H++4e-═2H2O,总的电极反应式为:2CH2=CH2+O2→2CH3CHO,以此解答该题.
解答 解:A、该电化学装置是将化学能转化为电能,所以该电化学装置是原电池,故A错误;
B、负极是乙烯发生氧化反应,所以a极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+,故B正确;
C、正极发生还原反应,所以氧气在b极被还原,故C错误;
D、电子经过外电路,不经过溶液,故D错误;
故选B.
点评 本题考查了原电池原理的应用,为高频考点,注意掌握电极方程式的书写是解决本题的关键,易错点为D,注意电子不能流经溶液,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
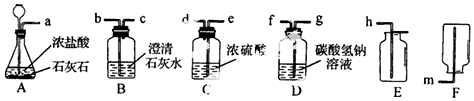
 某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.
某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:实验题
I.高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制480mL 0.1000 mol·L-1的酸性KMnO4溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、 。
②下列操作对实验结果的影响偏大的是 (填序号)。
a.加水定容时俯视刻度线
b.容量瓶底部有少量蒸馏水
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.天平的砝码生锈
(2)某化学兴趣小组,用新配制的酸性KMnO4溶液来测定某试剂厂生产的FeSO4溶液中Fe2+的物质的量浓度。
①酸性高锰酸钾溶液与FeSO4溶液反应的离子方程式为
②该小组在测定过程中发现,测得的Fe2+的物质的量浓度比标签上的标注值要低,在滴定操作准确的前提下,可能导致该测定结果的原因如下:
猜想一:FeSO4溶液变质;证明方法是
猜想二:
Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(1)写出该反应的化学方程式:________________________;
(2)该反应体系中,若用浓盐酸代替硫酸,用离子方程式表示后果: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com