
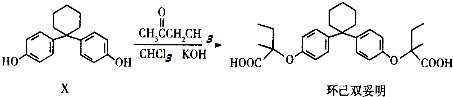
| A. | 有机物X的分子式为C18H22O2 | |
| B. | 有机物X与环己双妥明互为同系物 | |
| C. | 环己双妥明苯环上的一氯代物有4种 | |
| D. | 环己双妥明能与碳酸氢钠溶液发生反应 |
分析 A.由X的结构简式确定元素的种类和数目,可确定分子式;
B.有机物X与环己双妥明含有的官能团不同;
C.环己双妥明的两个苯环相同,有2种不同的H原子;
D.环己双妥明含有羧基,具有酸性.
解答 解:A.由结构简式可确定分子式为C18H20O2,故A错误;
B.有机物X含有酚羟基,环己双妥明含有羧基,二者官能团不同,不是同系物,故B错误;
C.环己双妥明的两个苯环相同,有2种不同的H原子,则一氯代物有2种,故C错误;
D.环己双妥明含有羧基,具有酸性,可与碳酸氢钠反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸性质的考查,注意把握有机物的结构以及相关概念的理解,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3与NaOH | B. | NaHSO4与Ba(OH)2 | C. | Na2CO3与HCl | D. | NaAlO2与H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A,B分别为0.4mol•L-1,0.2mol•L-1 | B. | A为0.25mol•L-1 | ||
| C. | A,C均为0.15mol•L-1 | D. | A为0.24mol•L-1,C为0.14mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂粉精溶液中通入过量的二氧化碳:ClO-+H2O+CO2═HClO+HCO3- | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 二氧化锰与浓盐酸反应:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+2Cl2↑, | |
| D. | 碳酸钙粉末与新制氯水反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- | |
| B. | 由实验(1)无法推断原混合溶液中是否含有SO42- | |
| C. | 由实验(2)无法推断原混合溶液中是否含有Fe3+ | |
| D. | 由实验(3)可推断原混合溶液中存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①量取15.00mL的NaOH溶液 | |
| B. | 用装置②制备并收集Cl2 | |
| C. | 用装置③陶瓷坩埚高温煅烧CaCO3固体 | |
| D. | 关闭活塞a,从b处加水,以检查装置④的气密性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com