
 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.| △c |
| △t |
 CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),| 2.25mol/L |
| 10min |
| 2.25 |
| 3 |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |


科目:高中化学 来源: 题型:
| A、CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O═4Al(OH)3↓+3CH4↑ |
| B、O2与Cu加热反应生成CuO,则S与Cu加热反应生成CuS |
| C、根据化合价Fe3O4可表示为FeO?Fe2O3,则Fe3I8也可表示为FeI2?2FeI3 |
| D、SO2通入BaCl2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
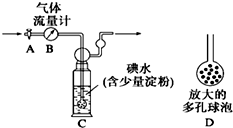 某化学兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
某化学兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.回答下列问题:
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、苯酚和羟基扁桃酸互为同系物 |
| B、羟基扁桃酸分子中至少有12个原子共平面 |
| C、乙醛酸在核磁共振氢谱中只有1个吸收峰 |
| D、常温下,1 mol羟基扁桃酸只能与1 mol Br2反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com