
【题目】白磷与氧气可发生如下反应:P4+5O2=P4O10已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
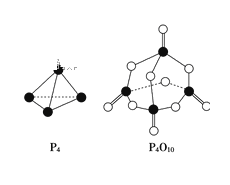
A. (4c+12b-6a-5d) kJ·mol-1 B. (6a+5d-4c-12b) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1 D. (4c+5d-4a-12b) kJ·mol-1
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法错误的是( )
A.硅是构成岩石和矿物的基本元素
B.粗硅制备单晶硅不涉及氧化还原反应
C.高纯度的硅单质广泛用于制作半导体材料
D.水泥、玻璃、陶瓷都是硅酸盐产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有 ( )
A. ①②⑥ B. 全部 C. ①③④⑤ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是( )

A. 由红外光谱可知,A中含有C-H键、C=O键、![]() 等
等
B. 由核磁共振氢谱可知,该有机物分子中有4种不同化学环境的氢原子
C. 若A的化学式为C8H8O2,则其结构简式可能为![]()
D. 由以上信息可以推测A分子可能为含有酯基的芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成纳米氧化铜的重要前驱体之一,可采用苯乙腈(![]() )为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。
)为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。
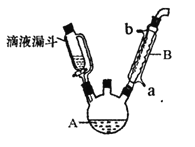
在250mL三口瓶A中加入70mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入46.8g苯乙腈,然后升温至130℃,发生反应:
![]() +2H2O+H2SO4
+2H2O+H2SO4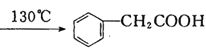 +NH4HSO4
+NH4HSO4
请回答:
(1)甲同学提出为使反应物受热均匀,可以采取水浴加热。老师否定了这个建议,原因是_______。
(2)乙同学提出装置中缺少温度计,温度计水银球的合理位置是_______。
(3)本实验采用了滴液漏斗。与普通分液漏斗相比,滴液漏斗的优点是_______。
(4)反应结束后需先加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______,分离出苯乙酸的操作是_______。
(5)提纯粗苯乙酸最终得到19g纯品,则苯乙酸的产率是_____%(结果保留整数)。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。此步骤中用到乙醇的作用是______;写出此步发生反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A有如下的转化关系:
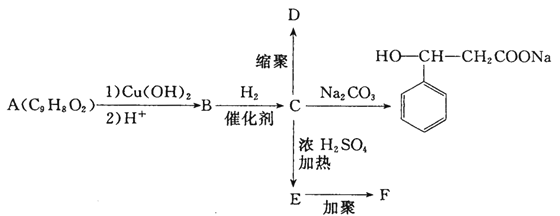
请结合上述转化关系回答问题:
(1)A的结构简式为_____;M是比A少一个CH2原子团的芳香族化合物,能发生银镜反应,且M在所有的同分异构体中核磁共振氢谱信号种类最少,则M的结构简式为_______。
(2)A→B的反应类型为_______。
(3)B→C的化学方程式为_______。
(4)C→E的化学方程式为_______ 。
(5)D、F的结构简式分别为_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成____________色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com