
| 5 |
| 2 |


科目:高中化学 来源: 题型:
(1)(8分)某反应体系中的物质有NaOH、Au2O3,Na2S4O6,Au2O,H2O,Na2S2O3。Au2O3为反应物,回答下列部题
A.NaOH是 (反应物、生成物)
B.Na2S4O6是 (氧化剂、还原剂、氧化产物、还原产物)
C.氧化剂和还原剂的物质的量之比是
D.0.25mol Au2O3发生反应,转移电子数是
(2)(3分)在酸性条件下MnO4-将SO2氧化成SO42-的同时被还原成Mn2+.写出反应的离子方程式并配平:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江大庆铁人中学高一上学期期中考试化学试卷 题型:填空题
(1)(8分)某反应体系中的物质有NaOH、Au2O3,Na2S4O6,Au2O,H2O,Na2S2O3。Au2O3为反应物,回答下列部题
| A.NaOH是(反应物、生成物) |
| B.Na2S4O6是(氧化剂、还原剂、氧化产物、还原产物) |
| C.氧化剂和还原剂的物质的量之比是 |
D.0.25mol Au2O3发生反应,转移电子数是 |
查看答案和解析>>
科目:高中化学 来源:2010年广西南宁二中高三10月月考(理综)化学部分 题型:填空题
本题含两小题,共14分。
(1)(8分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将Au2O3之外的物质分别填如以下空格内,配平后标出电子转移的方向和数目。
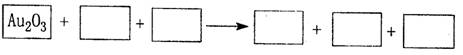
②反应中,被还原的元素是 ,还原剂是 。
③纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,,则还原剂与氧化剂物质的量之比为
。
(2)(6分)按要求写出有水参与的氧化还原反应的化学方程式
①水是氧化剂:
②水是还原剂:
③水既不是氧化剂也不是还原剂:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com