
【题目】如图所示与对应叙述相符的是
A.图 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则 Ksp(FeS)<Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则 Ksp(FeS)<Ksp(CuS)
B.图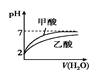 表示等体积的pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
表示等体积的pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C.某温度下向20 mL 0.1 mol·L-1的CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,pH变化曲线如图所示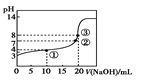 (忽略温度变化),则①点(CH3COO—)>c(Na+)>c(CH3COOH)
(忽略温度变化),则①点(CH3COO—)>c(Na+)>c(CH3COOH)
D.图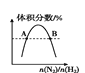 表示反应N2(g)+3H2(g)
表示反应N2(g)+3H2(g)![]() 2NH3(g)平衡时NH3体积分数随起始 n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始 n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
【答案】C
【解析】
A.根据FeS和CuS的溶度积表达式分析二者溶度积大小;
B.溶液酸性越强,稀释溶液时pH变化幅度越大;
C.①点NaOH不足,溶液成分为醋酸和醋酸钠,溶液呈酸性;
D.氮气的物质的量不同,对平衡移动的影响不同。
A.Ksp(FeS)=c(Fe2+)c(S2-),Ksp(CuS)=c(Cu2+)c(S2-),根据图象,c(S2-)相同时,c(Fe2+)>c(Cu2+),所以Ksp(FeS)>Ksp(CuS),故A错误;
B.溶液酸性越强,稀释溶液时pH变化幅度越大,根据图象,稀释溶液时,甲酸的pH变化幅度更大,所以甲酸的酸性更强,即酸性甲酸>乙酸,故B错误;
C.①点NaOH不足,溶液成分为等量的醋酸和醋酸钠,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,则c(CH3COO-)>c(Na+)>c(CH3COOH),故C正确;
D.氮气的浓度越大,越有利于平衡正向移动,氢气的转化率越大,则转化率:αA(H2)<αB(H2),故D错误,
故选:C。


科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为:
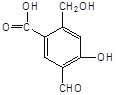
(1)A与过量的NaOH溶液反应时,A与参加反应的NaOH的物质的量之比是____________。
(2)A与新制Cu(OH)2反应时,A与被还原的Cu(OH)2的物质的量之比是___________。1molA最多能消耗____________mol Cu(OH)2。
(3)A与过量的NaHCO3反应时,A与NaHCO3的物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁水解的离子方程式为______________,其溶液中离子浓度大小顺序为_____________。现向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其反应的离子方程式为:__________________。同时有红褐色沉淀生成,其原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下某二元酸发生如下电离:H2A=H++HA-;HA-![]() H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
A. NaHA溶液呈酸性,因为HA-的电离程度大于水解程度
B. 常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的108倍
C. 常温下pH=2的H2A溶液中c(A2-)小于c(HA-)
D. 0.1mol/LH2A溶液中c(A2-)+c(HA-)+c(H2A)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大。气体AB遇空气变红棕色,C原子内层电子数是最外层电子数的5倍,D在同周期元素中电负性最大,E的硫酸盐溶液呈蓝色。回答下列问题:
(1)A原子有________种能量不同的电子;D原子的M能层电子的运动状态有________种。
(2)元素A的第一电离能________(填“大于”“小于”或“等于”)元素B的第一电离能;AB2-的立体构型是________;气体AB中含有的σ键和π键个数之比为________。
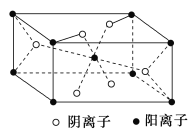
(3)元素C与D所形成的化合物的某种晶胞结构如图所示,则晶胞中阴离子与阳离子的个数比是________.
(4)E基态原子的核外电子排布式为________,将E单质的粉末加入A的简单气态氢化物的浓溶液中,并不断鼓入空气充分反应,得到深蓝色的溶液,该反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。向NaCN溶液中通入少量的H2S气体,反应的化学方程式为__________。
(2)在一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_____(用含a和b的代数式表示)。
(3)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,则25 ℃时,0.1 mol·L-1NaHC2O4显____性,理由是___,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液中c(H+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫酸铁净水原因(离子方程式):_____,SnCl2水解成碱式氯化亚锡(化学方程式)_____,要除去CuCl2溶液中FeCl3,可以向溶液中加入_______,将AlCl3溶液蒸干并灼烧所得固体的化学式为___。
(2)以石墨为电极,电解FeI2溶液,阳极电极反应式为________,利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
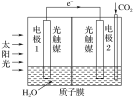
①电极2的电极反应式是_______;
②在标准状况下,当电极2室有11.2 L CO2反应。理论上电极1室液体质量___ (填“增加”或“减少”)___ g。
(3) 离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_____极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________。
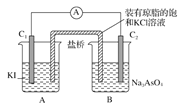
(4)已知AsO43—+2I-+2H+![]() AsO33—+I2+H2O是可逆反应,设计如图装置(C1、C2均为石墨电极)开始时:C2棒电极反应式______,当电流表___时,反应达到化学平衡状态。
AsO33—+I2+H2O是可逆反应,设计如图装置(C1、C2均为石墨电极)开始时:C2棒电极反应式______,当电流表___时,反应达到化学平衡状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO、CO2的回收对减少碳的排放、改善生态环境和构建生态文明具有重要的意义。回答下列问题:
(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH=99 kJ·mol1
CH3OH(g) ΔH=99 kJ·mol1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ·mol1
CO(g)+H2O(g) ΔH=+41 kJ·mol1
则反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=_________。
CH3OH(g)+H2O(g) ΔH=_________。
(2)向容积相同的三个恒容密闭容器中分别通入一定量H2、CO,控制适当条件使其发生反应:2H2(g)+CO(g)![]() CH3OH(g),反应中有关数据如下表所示:
CH3OH(g),反应中有关数据如下表所示:
容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | |
c(H2) | c(CO) | c(CH3OH) | ||
A | 350 | 0.40 | 0.20 | 0.16 |
B | 350 | 0.80 | 0.40 | |
C | T | 0.40 | 0.20 | 0.05 |
反应从开始到达到平衡时,平均反应速率:容器A____容器C(填“>”或“<”,后同),容器B中CO的转化率____80%。
(3)①CO2和H2在一定条件下能发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
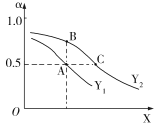
X表示___(填“温度”或“压强”),状态A、B、C对应的平衡常数K(A)、K(B)、K(C)的相对大小顺序为_____。
②向M、N两个初始容积相同的密闭容器中各充入2 mol CO2 和6 mol H2,控制适当条件使其发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
(4)用NaOH溶液做碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=10的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(
)=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.分子式为C4H8Cl2的有机物共有8种
C.含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D.菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com