
已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:

①写出n (OH―)、n (Ca2+)与n (Na+)的关系:n(Na+)= 。
②设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
碱石灰的 可能组成 | NaOH、CaO | NaOH、CaO、 Ca (OH)2 | NaOH、 Ca (OH)2 | NaOH、 Ca (OH)2、H2O |
n (Na+)、n (Ca2+) 的关系 | 40x+56y = 4 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。
他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g。请通过计算确定该碱石灰中各成分的质量分数。
科目:高中化学 来源: 题型:
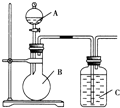 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/℃ | 沸点/℃ |
三氯化磷 | -122 | 76 |
五氯化磷 | 148 | 200 ℃分解 |
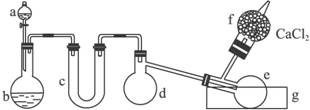
(1)有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a、b中应该装入的试剂分别是:a________,b________。
(2)________(填仪器对应的字母)仪器需要加热。
(3)生成的三氯化磷在蒸馏烧瓶e中收集。为保证三氯化磷蒸气冷凝,应在水槽g中加入________。
(4)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及装入其中的物质都不能含有水分。为除去氯气中的水分,c可以装入下列物质中的________(填字母)。
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)氯气和白磷反应放出大量的热,为使具支烧瓶d不致因局部过热而炸裂,实验开始前应在烧瓶的底部放少量________。
(6)实验室的白磷保存于水中,取出白磷后用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知水与酒精互溶,酒精与乙醚互溶,用上述方法可除去水的原因是________________________________________________________。
(7)为防止氯气污染空气,装置末端导出的气体最好用(填字母)________进行净化处理。
A.NaOH溶液 B.Ca(OH)2溶液 C.饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
用图1-3所示装置(酒精灯、铁架台等未画出)制取三氯化磷。在具支烧瓶d中放入足量白磷,将氯气迅速而又不间断地通入具支烧瓶中,氯气与白磷就会发生反应,产生火焰。三氯化磷和五氯化磷的物理常数见下表。
| 熔点/℃ | 沸点/℃ | |
| 三氯化磷 | -122 | 76 |
| 五氯化磷 | 148 | 200 ℃分解 |
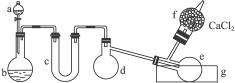
图1-3
(1)有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a、b中应该装入的试剂分别是:a________,b________。
(2)________(填仪器对应的字母)仪器需要加热。
(3)生成的三氯化磷在蒸馏烧瓶e中收集。为保证三氯化磷蒸气冷凝,应在水槽g中加入________。
(4)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及装入其中的物质都不能含有水分。为除去氯气中的水分,c可以装入下列物质中的________(填字母)。
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)氯气和白磷反应放出大量的热,为使具支烧瓶d不致因局部过热而炸裂,实验开始前应在烧瓶的底部放少量________。
(6)实验室的白磷保存于水中,取出白磷后用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知水与酒精互溶,酒精与乙醚互溶,用上述方法可除去水的原因是________________________________________________________。
(7)为防止氯气污染空气,装置末端导出的气体最好用(填字母)________进行净化处理。
A.NaOH溶液 B.Ca(OH)2溶液 C.饱和食盐水
查看答案和解析>>
科目:高中化学 来源:2009年上海市松江区高考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com