
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
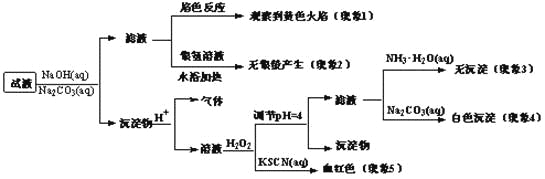
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】碲及其化合物是半导体材料。
(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液的pH约为_____________(填代号)。
A.0.7 B.1 C.2 D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-浓度大小的排序为____________________。
(2)工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)冶炼碲,其工艺流程如下(已知TeO2微溶于水,易与浓强碱.浓强酸反应):

①铜阳极泥溶于硫酸时加压的目的是_____________________________________________;
若调节pH时,pH过低,则粗碲产率会_____________(填“增大”“减小”或“不变”)。
②上述流程中可以循环利用的物质是____________________。
③写出铜阳极泥转化成TeO2的化学方程式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度, ![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池反应原理如图所示,下列说法正确的是
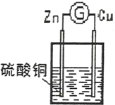
A. 在溶液中,SO42-移向正极 B. 在溶液中,电子从锌片流向铜片
C. 一段时间后,溶液颜色变浅 D. 负极电极反应式为:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究 , 其结构简式如图。下列关于分枝酸的叙述正确的是( )
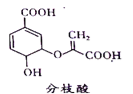
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol分枝酸最多可与3 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在一定条件下反应生成NH3(g),过程如下图,下列说法正确的是
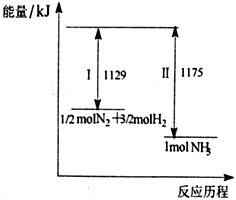
A. I为放热过程、Ⅱ为吸热过程
B. 1/2 molN2和3/2molH2的键能之和大于1 mol NH3的键能
C. 1/2molN2和3/2molH2所具有的能量之和低于1 mol NH3所具有的能量
D. 该过程的热化学反应方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题: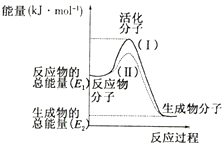
(1)图中所示反应是(填“吸热”或“放热”)反应,该反应的△H=(用含E1、E2的代数式表示)。
(2)下列4个反应中符合示意图描述的反应的是____________(填代号)。
A.水蒸气与炭反应
B.用水稀释氢氧化钠溶液
C.铝粉与Fe2O3反应
D.灼热的碳与CO2反应
(3)已知热化学方程式:H2(g)+ ![]() O2 (g)=H2O(g)△H=-241.8kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为。
O2 (g)=H2O(g)△H=-241.8kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4 (g)+H2O(g)=CO(g)+3H2(g)△H=+206.2 kJ/mo1
CH4(g)+CO2 (g)=2CO(g)+2H2 (g)△ H=+247.4kJ/mo1
CH4 (g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在一个1L的密闭容器中,加入2molA和1 mol B,发生下列反应:
2A(g) + B(g) ![]() 3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
①维持容器的温度不变,若缩小容器的体积,则平衡向(填“正反应方向”、“逆反应方向”或“不”)移动。
②维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol/L的是(填序号);
A.4 mol A+2 mol B
C.2 mol A+1 mol B+3 mol C
B.3 mol C+2molD
③达平衡后若升高温度,B的浓度增加,则正反应的△H(填“>”、“<”或“=”)0。
(2)下图1 mol NO2和1 mol CO反应生成CO2和NO中,CO和NO的浓度随时间变化的示意图。回答下列问题:
①从反应开始到t1时刻,用NO2浓度变化表示平均反应速率v(NO2)=。
②此温度下该反应的平衡常数K=。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况下),经充分燃烧后,一共放出热量710.0 kJ,并生成液态水。下列说法正确的是( )
A. CO燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=+282.8 kJ/mol
B. H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ/mol
C. 燃烧前的混合气体中,H2的体积分数为40%
D. 混合气体燃烧后与足量的过氧化钠反应,电子转移总数为2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com