
【题目】(化学——选修5:有机化学基础)
芳香烃A可以合成扁桃酸,也可以合成H。以下是合成线路(部分产物、反应条件已略去):
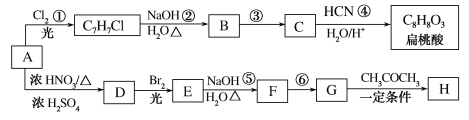
已知:
I、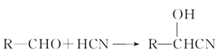
II、![]()
III、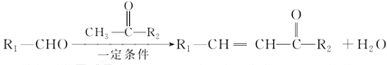
IV、D的相对分子质量为137,且在苯环的对位上有两个取代基
V、E为一溴取代物
请回答下列问题:
(1)扁桃酸中含氧官能团的名称是 ________;物质B的结构简式 ________。
(2)上述①~⑥反应中属于取代反应的是 ________(填序号)。
(3)关于H物质,下列说法正确的是 ________ (填字母序号)。
A.所有碳原子可能处于同一平面
B.可以发生加成反应、聚合反应、氧化反应和还原反应
C.H与G都能与新制Cu(OH)2反应
(4)写出反应⑥的化学方程式 ________。
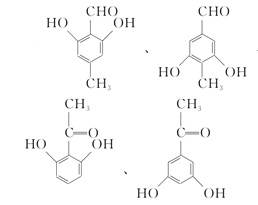
(5)X是扁桃酸的同分异构体,1 mol X可与2 mol Na2CO3反应,其核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,其结构简式为 ________ (任写两种)。
(6)请结合所学知识和上述信息,写出由A和乙醛为原料(无机试剂任用)制备肉桂醛(![]() )的合成路线流程图 ________。
)的合成路线流程图 ________。
【答案】羧基、羟基 ![]() ①、②、⑤ AB
①、②、⑤ AB 
 (任写两种)
(任写两种) 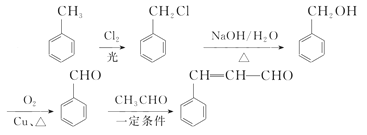
【解析】
A为芳香烃,在光照条件下可与氯气反应生成C7H7Cl,根据碳元素守恒可知,A为甲苯(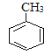 ),则反应②为氯原子被羟基取代的过程,B为苯甲醇(
),则反应②为氯原子被羟基取代的过程,B为苯甲醇(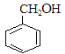 ),根据提示条件可知,C中含有醛基,则结合反应③推出C为苯甲醛(
),根据提示条件可知,C中含有醛基,则结合反应③推出C为苯甲醛(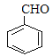 ),结合给定反应I、II可知扁桃酸的结构简式为:
),结合给定反应I、II可知扁桃酸的结构简式为: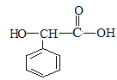 ;A合成H的路线中,先发生硝化反应生成D,因D的相对分子质量为137,且苯环对位上有两个取代基,可知D的结构简式为
;A合成H的路线中,先发生硝化反应生成D,因D的相对分子质量为137,且苯环对位上有两个取代基,可知D的结构简式为 ,E为一溴取代物,则结构简式为:
,E为一溴取代物,则结构简式为: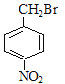 ,E经过氢氧化钠水溶液加热的情况下,生成F,则F为
,E经过氢氧化钠水溶液加热的情况下,生成F,则F为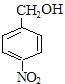 ,再经过氧化反应生成G,G为
,再经过氧化反应生成G,G为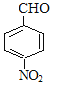 ,再结合反应III可推知H为
,再结合反应III可推知H为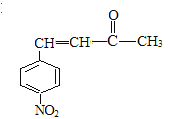 ,据此分析作答。
,据此分析作答。
(1)根据上述分析可知,扁桃酸的结构简式为: ,则其含氧官能团的名称为羧基、羟基,物质B的结构简式为
,则其含氧官能团的名称为羧基、羟基,物质B的结构简式为![]() ,
,
故答案为:羧基、羟基;![]() ;
;
(2)根据分析可知,氯代反应、卤素原子的水解反应为取代反应,即①、②、⑤为取代反应,
故答案为:①、②、⑤;
(3)H为 ,则
,则
A. 苯环为平面结构,碳碳双键也为平面结构,则H中的所有碳原子可能处于同一平面,故A项正确;
B. H结构中含有碳碳双键,可以发生加成反应、聚合反应,同时含有羰基,可发生氧化反应和还原反应,故B项正确;
C. G为 ,含有醛基,可与新制Cu(OH)2反应,而H中没有醛基,则不能与新制Cu(OH)2反应,故C项错误;
,含有醛基,可与新制Cu(OH)2反应,而H中没有醛基,则不能与新制Cu(OH)2反应,故C项错误;
答案选AB;
(4)反应⑥是醇氧化为醛的过程,其化学方程式为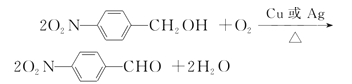 ,
,
故答案为: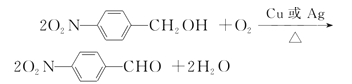 ;
;
(5)X是扁桃酸的同分异构体,则其分子式为C8H8O3,不饱和度 = ![]() = 5,分子内含苯环,占据4个不饱和度,又1 mol X可与2 mol Na2CO3反应,则推知分子内含两个酚羟基,和一个醛基或羰基;又因为其核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,说明有四种不同环境的氢原子,且原子个数比为3:2:2:1,则其结构简式可以为:
= 5,分子内含苯环,占据4个不饱和度,又1 mol X可与2 mol Na2CO3反应,则推知分子内含两个酚羟基,和一个醛基或羰基;又因为其核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,说明有四种不同环境的氢原子,且原子个数比为3:2:2:1,则其结构简式可以为: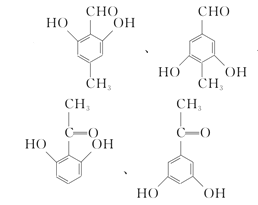 ,
,
故答案为: (任写两种);
(任写两种);
(6)采用逆合成分析法可知,若要制备肉桂醛(![]() ),则需要先制备苯甲醛,再结合提示信息给出的反应III便可获得肉桂醛。A为甲苯,可通过合成G的思路合成苯甲醛,即其合成路线为:
),则需要先制备苯甲醛,再结合提示信息给出的反应III便可获得肉桂醛。A为甲苯,可通过合成G的思路合成苯甲醛,即其合成路线为: ,
,
故答案为: 。
。


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素T、Q、R、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是
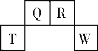
A. R的氢化物可以既有极性键又有非极性键
B. 常温下丁的浓溶液可用T单质所制的容器来盛装
C. 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体
D. 甲、乙、丙、丁受热均易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期律和元素周期表,下列推断不合理的是( )
A. 第84号元素的最高化合价是+7
B. 第七周期0族元素的原子序数为118
C. 第35号元素的单质在常温常压下是液体
D. 位于第四周期第VA族的元素为非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应:A(s)+3B(g) ![]() 2C(g),下列说法说明达到平衡状态的是( )
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③气体密度不再变化;④混合气体的总压强不再变化;⑤A、B、C的物质的量之比为1∶3∶2;⑥C的体积分数不再变化
A. ②④⑤ B. ①③④⑥
C. ①②④⑥ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A. 将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B. 向纯水中加入少量NaOH溶液,平衡逆向移动, KW变小
C. 向纯水中加入少量盐酸,平衡逆向移动,c(H+)增大,KW不变
D. 向纯水中加入醋酸钠,平衡正向移动,KW增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探讨化学平衡移动原理与氧化还原反应规律的联系,实验如下。
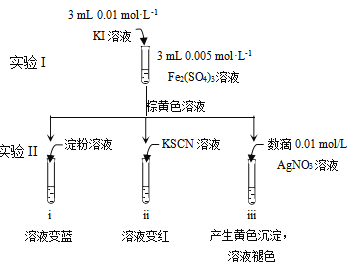
下列说法不正确的是
A. 试管i溶液变蓝证明有I2生成
B. 结合试管i、ii中现象,可知2Fe3++2I-![]() 2Fe2++I2
2Fe2++I2
C. 试管iii中溶液褪色说明I2转化为I-,此时I-还原性强于Fe2+
D. 对比实验I和试管iii中现象,说明物质的氧化性与还原性强弱受浓度影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度下,将2mol A和3mol B充入一密闭容器中发生如下反应:aA(g)+B(g)![]() C(g)+D(g),5 min后达到平衡。已知该温度下反应的平衡常数K=1,在t0时刻,若保持温度不变将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+D(g),5 min后达到平衡。已知该温度下反应的平衡常数K=1,在t0时刻,若保持温度不变将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
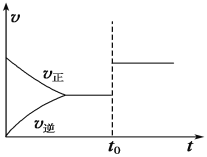
A. 正反应是一个体积减小的反应,a=2
B. 速率随时间的变化关系可用上图表示
C. 达平衡时B的转化率为40%
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com