
【题目】28g CO气体在1mol的氧气中燃烧后,所得的气体通过足量Na2O2固体中充分反应后,下列说法不正确的是( )
A. CO与氧气反应,只消耗了0.5mol氧气
B. 充分反应后Na2O2固体质量增加了28 g
C. 通过以上两步反应后余下氧气物质的量为0.5mol
D. 若2gH2替代 28g的CO发生上述反应,则Na2O2固体质量增加了2g
【答案】C
【解析】
28g CO气体的物质的量为![]() =1mol,在1mol的氧气中燃烧后,2CO+O2
=1mol,在1mol的氧气中燃烧后,2CO+O2![]() 2CO2,生成1mol二氧化碳,剩余0.5mol氧气,通过足量Na2O2固体发生的反应为2Na2O2 +2CO2 = 2Na2CO3 + O2,据此分析解答。
2CO2,生成1mol二氧化碳,剩余0.5mol氧气,通过足量Na2O2固体发生的反应为2Na2O2 +2CO2 = 2Na2CO3 + O2,据此分析解答。
A.根据上述分析,CO与氧气反应,只消耗了0.5mol氧气,故A正确;
B.2Na2O2 +2CO2 = 2Na2CO3 + O2,充分反应后Na2O2固体质量的增加量与CO的质量相等,为28 g,故B正确;
C.2CO+O2![]() 2CO2,2Na2O2 +2CO2 = 2Na2CO3 + O2,通过以上两步反应,余下氧气的量不变,物质的量仍为1mol,故C错误;
2CO2,2Na2O2 +2CO2 = 2Na2CO3 + O2,通过以上两步反应,余下氧气的量不变,物质的量仍为1mol,故C错误;
D.2gH2的物质的量为![]() =1mol,燃烧生成水后与过氧化钠反应,2Na2O2 + 2H2O = 4NaOH + O2 ↑,Na2O2固体质量的增加量等于氢气的质量,为2g,故D正确;
=1mol,燃烧生成水后与过氧化钠反应,2Na2O2 + 2H2O = 4NaOH + O2 ↑,Na2O2固体质量的增加量等于氢气的质量,为2g,故D正确;
故选C。


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】功能高分子I的一种合成路线如下,其中D能与Na反应生成H2,且D苯环上的一氯代物有2种。

已知:![]()
回答下列问题:
(1)A的名称为________,试剂a为________________。
(2)C的结构简式为________________________。
(3)F中的官能团名称为________。
(4)上述①—⑧的反应中,不属于取代反应的是________(填数字编号)。写出反应⑦的化学方程式________________________________________。
(5)符合下列条件的B的同分异构体有________种。
①苯环上有氨基(—NH2) ②能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的结构简式为__________。
(6)参照上述合成路线,以1-丁烯为原料(无机试剂任选),设计制备丙烯酸(CH2=CHCOOH)的合成路线________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I CO(g)+2H2(g)![]() CH3 OH(g) △H1
CH3 OH(g) △H1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2
Ⅲ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
则3CO(g)+3H2(g)![]() CH2OCH3(g)+CO2(g) △H=___________(用△H1、△H2、△H3表示)。
CH2OCH3(g)+CO2(g) △H=___________(用△H1、△H2、△H3表示)。
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H测得CH3OH的浓度与温度关系如图所示:
CH3OCH3(g)+H2O(g) △H测得CH3OH的浓度与温度关系如图所示:

①T1___________T2;△H___________0(填“>”“<”或“=”)。
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________(填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成CH3OH的反应表示为:2H2(g)+CO(g)![]() CH3OH(g) △H=-91.0kJ·mol-1。向1L的恒容密闭容器中加入0.1molH2和0.05 mol CO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ
CH3OH(g) △H=-91.0kJ·mol-1。向1L的恒容密闭容器中加入0.1molH2和0.05 mol CO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ
①从反应开始恰好到平衡状态,H2的平均反应速率v(H2)=______________________。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,CH3OH的正反应速率___________CH3OH的逆反应速率(填“大于”“小于”或“等于”)。
(4)氨气是重要化工原料,也可以作能源。常温下,将c1mol·L-1氨水和c2mol·L-1盐酸等体积混合,得到溶液中c(NH4+)=c(Cl-)。在该溶液中离子浓度大小排序为___________。常温下,NH3·H2O的电离常数Kb=___________(用含c1、c2字母的式子表示)
(5)肼(N2H4)一空气燃料电池中氧化产物对环境友好。装置如图所示。

已知:电流由Y极经外电路流向X极,下列有关说法正确的是___________(填代号)
A.放电过程中,OH-向Ⅹ极迁移
B.放电过程中,Y极区电解质溶液的pH减小
C.X极的电极反应式为N2H4-4e-=N2↑+4H+
D.电路上转移2mol电子时至少消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内某科技研究小组首次提出一种新型的Li+电池体系,该体系征集采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液采用LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知:I-+I2=I3-,则下列有关判断正确的是
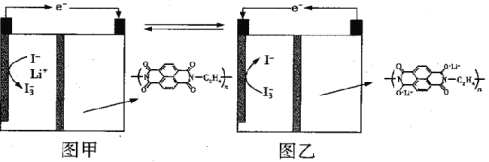
A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 充电时,Li+从右向左通过聚合物离子交换膜
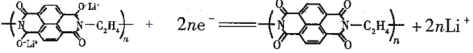
D. 放电时,负极的电极反应式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是
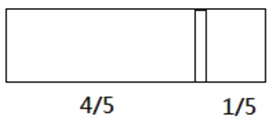
A. 左边CO和CO2分子数之比为1:3
B. 右边CO的质量为14g
C. 右边气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端![]() 处,若保持温度不变,则前后两次容器内的压强之比为5:6
处,若保持温度不变,则前后两次容器内的压强之比为5:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法不正确的是

A. 放电时,铝为负极,石墨为正极
B. 放电时的负极反应为:Al-3e-+7AlCl4-===4Al2Cl7-
C. 充电时的阳极反应为:Cx+ AlCl4--e-===CxAlCl4
D. 放电时,有机阳离子向铝电极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
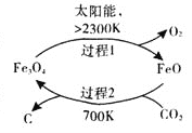
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。
(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)
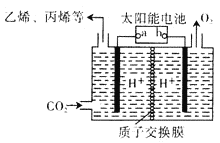
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com