(2012?潮州二模)为减少和消除CO
2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO
2创新利用的研究.甲醇是一种可再生燃料,它的沸点为64.7℃.有科学家提出绿色构想:把含有CO
2的空气或工业尾气通入碳酸钾溶液中,然后再把CO
2从溶液中提取出来,经化学反应后得到甲醇,其构想流程如下:(相对原子质量:C-12 O-16 Ca-40 Ba-137)
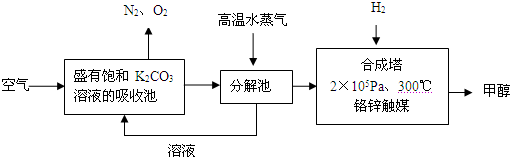
试回答下列问题:
(1)写出分解池中发生反应的化学方程式
.
(2)在2×10
5Pa、300℃合成塔中,若有CO
2与H
2反应生成32g甲醇和水,放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式:
CO2(g)+3H2(g)=CH3OH (g)+H2O(g)△H=-49.5kJ?mol-1
CO2(g)+3H2(g)=CH3OH (g)+H2O(g)△H=-49.5kJ?mol-1
_
删去此空
删去此空
.
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,合成塔中维持300℃的较高温度的原因可能是
该温度下催化剂的活性最高(较低温时反应速率过慢,生产效率低)
该温度下催化剂的活性最高(较低温时反应速率过慢,生产效率低)
;若要提高甲醇的产率,可采取的措施有(写2条):
降温
降温
、
加压或将水和甲醇从混合体系中分离出来
加压或将水和甲醇从混合体系中分离出来
.
(4)甲醇的一个重要作用是制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:
CH3OH+8OH--6e-=CO32-+6H2O或:2CH3OH+16OH--12e-=2CO32-+12H2O
CH3OH+8OH--6e-=CO32-+6H2O或:2CH3OH+16OH--12e-=2CO32-+12H2O
.
(5)常温常压下,饱和CO
2水溶液的pH=5.6,c (H
2CO
3)=1.5×10
-5mol?L
-1,若忽略水的电离和H
2CO
3的二级电离,则H
2CO
3?HCO
3-+H
+的平衡常数K=
4.2×10-7 mol?L-1
4.2×10-7 mol?L-1
(计算结果保留2位有效数字,己知10
-5.6=2.5×10
-6).
(6)某同学拟用沉淀法测定空气中CO
2的体积分数,他查得CaCO
3、BaCO
3的溶度积常数分别为4.96×10
-9、2.58×10
-9,该同学应该选用较合适的试剂是
AD
AD
(填字母).
A.Ba(OH)
2溶液 B.Ca(OH)
2溶液
C.BaCl
2和NaOH混合溶液 D.CaCl
2溶液.



 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.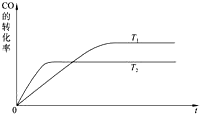 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).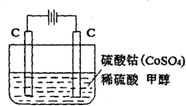 电化学法可消除甲醇(CH3OH)对水质造成的污染.其原理是:通电后Co2+被氧化成Co3+,生成的Co3+把水中的甲醇氧化:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.某学习小组用如图装置进行实验.下列说法错误的是( )
电化学法可消除甲醇(CH3OH)对水质造成的污染.其原理是:通电后Co2+被氧化成Co3+,生成的Co3+把水中的甲醇氧化:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.某学习小组用如图装置进行实验.下列说法错误的是( )