
ij��ҵ��ˮ�н����±������е�5�֣�
������ | K+ Cu2+ Fe3+ Ca2+ Fe2+ |
������ | Cl- CO32- NO3- SO42- SiO32- |
ijͬѧ��̽����ˮ����ɣ�����������ʵ�飺
��ȡ��ˮ���������������ᣬ�ް�ɫ��������,��������ʹ����ʯ��ˮ����ǵ���ɫ��ζ����
����������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɡ�
�����ƶϲ���ȷ����
A. ��Һ��һ�����е���������K+ �� Cl- ��CO32- ��NO3- �� SO42-
B. ���м�������������ɫ����ĵ����ӷ���ʽ��CO32-+2H+=CO2��+H2O
C. ԭ��Һ�е�K+ �� Cl- ��NO3- ���������ȷ��
D. ���в�����ɫ���������ӷ���ʽ��Ba2++SO42-=BaSO4��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꼪��ʡ�߶���ѧ�ڻ���ѵ����15����ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�����������������ȷ����
A. ��⾫��ͭ�Ĺ����У�ÿת��NA������ʱ�������ܽ�ͭ������Ϊ32g
B. 1 mol Na2O2�����к���������Ϊ4NA
C. 1mol�ǻ���17 g NH3����������֮��Ϊ9:10
D. һ���¶��£�1 L 0.5 mol��L��1NH4Cl��Һ��2 L 0.25 mol��L��1NH4Cl��Һ��NH�����ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и߶�����ʵ�����ѧ�ڵ�һ���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
����ӵ�صĹ㷺Ӧ��ʹ��﮵�صĻ�������һֱ�ǿ�ѧ�ҹ�ע�Ľ��㡣���������﮵��������ǰ�����������ϣ�����������ǰ���壬��ŵ�ʱ����ʵ���ת����ij�о���С��ԷϾ�����ӵ����������(ͼ�м�Ʒ��ϣ��ɷ�ΪLiFePO4��̼�ۺ�����)���н�����Դ�����о������ʵ���������£�
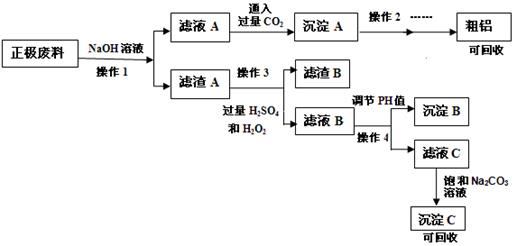
��֪���� FePO4������ϡH2SO4��������ˮ���������ᡣ
�� Li2SO4��LiOH��Li2CO3��273K�µ��ܽ�ȷֱ�Ϊ34.2g��22.7g��1.54g��
��373K�£�Li2CO3���ܽ��Ϊ0.72g
�� Ksp[Al(OH)3]=10-32 Ksp[Fe(OH)3]=4��10-38
��1������1�� ��
��2����ҺA��ͨ�����CO2�Ļ�ѧ����ʽΪ�� ��
��3��������߲���1�����ʵķ�����(д��3��) ��
��4����ɲ���3�е����ӷ���ʽ�� ��
��5����﮵�س��ʱ��������Ӧʽ�� ��
��6������4��Ӧѡ���Լ��� ��
��7������C�ijɷ֣� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ��һ�������������Բ��ԣ��ģ���b�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ҹ���ѧ�ҷ�����ˮ��Һ﮵��Ϊ�綯������չɨ�����ϰ���װ��ԭ������ͼ��ʾ�����й��屡Ĥֻ����Li+ͨ��������ӵ�ص��ܷ�ӦΪxLi +Li1-xMn2O4 LiMn2O4�������й�˵���������
LiMn2O4�������й�˵���������
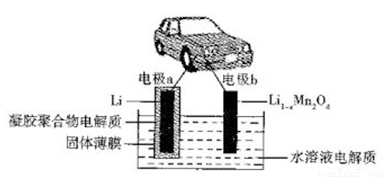
A. �ŵ�ʱ��Li+�������屡Ĥ���뵽ˮ��Һ�������
B. �ŵ�ʱ��������ӦΪLi1-xMn2O4+xLi++xe- LiMn2O4
LiMn2O4
C. �õ�ص�ȱ���Ǵ��ڸ���Ӧ:2Li +2H2O 2LiOH+H2��
2LiOH+H2��
D. ���ʱ���缫bΪ����������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ������2017�����1�½�ѧ������⻯ѧ�Ծ� ���ͣ������
�����£�N2H4���ǵ������ֳ���������ڿ�ѧ�������������й㷺Ӧ�á��ش��������⣺
��1����֪��N2(g)+3H2(g)  2NH3(g) ��H��-92.4kJ��mol-1
2NH3(g) ��H��-92.4kJ��mol-1
�ں��¡����ݵ��ܱ������У��ϳɰ���Ӧ�ĸ�����Ũ�ȵı仯������ͼ��ʾ��
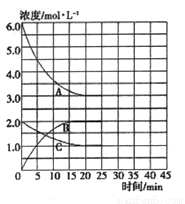
�� �����ڸ��¶��·�Ӧ2NH3(g)  N2(g)+3H2(g)��ƽ�ⳣ��K=________��
N2(g)+3H2(g)��ƽ�ⳣ��K=________��
�� �ڵ�25minĩ�����������������䣬�����¶Ƚ��ͣ��ڵ�35minĩ�ٴδﵽƽ�⡣��ƽ���ƶ�������N2Ũ�ȱ仯��0.5mol/L������ͼ�л���25-40minNH3Ũ�ȱ仯���ߡ�________
�� ��֪��2N2(g)+6H2O(l)  4NH3(g)+3O2��g����H=+1530.0KJ/mol����������ֵΪ_____��
4NH3(g)+3O2��g����H=+1530.0KJ/mol����������ֵΪ_____��
��2���� N2H4��һ�ָ���ȼ�Ͼ��л�ԭ�ԣ�ͨ����NaClO�����NH3��Ӧ�Ƶã������Ϊʲô�ù���������Ӧ��ԭ��__________
�� ��NaClO��NH3 ��N2H4�ķ�Ӧ���൱���ӵģ���Ҫ��Ϊ������
��֪��һ����NH3+ClO-=OH-+NH2Cl
��д���ڶ������ӷ���ʽ��__________________
�� N2H4������ˮ�����백�����Ƶ������֪�䳣���µ��볣��K1=1.0��10-6�������£���0.2 mol/L N2H4��H2O��0.lmol/L������������ϣ���������仯�������ʱ��Һ��PH����________������N2H4�Ķ������룩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ������2017�����1�½�ѧ������⻯ѧ�Ծ� ���ͣ�ѡ����
����˵���У�����ȷ����
A. �ⵥ���������˷���������Ӽ�������
B. ���ʯ��ʯī������̼����̼Ԫ�ص�ͬ��������
C. Ŀǰ��ѧ�һ���ʵ�ֶ�ԭ�ӻ���ӵIJ���
D. HCl��������ˮ���ۼ����ƻ����Ӷ��γ���H+��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ������2017�����1�½�ѧ������⻯ѧ�Ծ� ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��ȷ����
A. ����ӡˢ��·�壺Fe3++Cu=Cu2++Fe2+
B. �����ʵ�����Ba(OH)2��NH4HSO4��ϡ��Һ�з�Ӧ��Ba2++2OH-+2H++SO42-=BaSO4��+2H2O
C. Ca(OH)2��Һ������Ca(HCO3)2��Һ��Ӧ��Ca2++2HCO3-+2OH-=2CaCO3��+2H2O+CO32-
D. ���Ʊ�����ˮ�м���ʯ��ʯ�������Һ��HClOŨ�ȣ�CaCO3+2Cl2+H2O=Ca2++2Cl-+CO2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�Ͼ��и߶�ѧҵˮƽģ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������Ԫ��X��Y��Z��W��R�����ǵ�ԭ��������������X��ԭ�Ӱ뾶��С��Ԫ�أ�Y��Rͬ������Rԭ�Ӻ˵��������Yԭ�Ӻ˵������2����Z��Wԭ�ӵ�����������֮����Y��Rԭ�ӵ�����������֮����ȡ�����˵����ȷ����
A. X��Yֻ���γ�һ�ֻ�����
B. W��R������������ˮ�������ԣ�W>R
C. Y��R�ֱ���X�γɵĻ���������ȶ��ԣ�Y>R
D. ԭ�Ӱ뾶��r(Z)<r(Y)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�찲��ʡ������ʮУ������3���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��0.1000mol/L�ı�����ֱ�ζ�20.00mL��0.1000mol/L��ˮ��20.00mL��0.1000mol/L����������Һ�ĵζ�������ͼ��ʾ��������Ϊ�ζ��ٷ������ζ��������ܵζ���������������Ϊ�ζ���������ҺpH��������һ�����ָʾ������ɫ��ΧΪ4.4-6.2�������йصζ�����˵����ȷ����
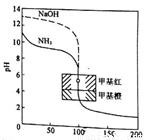
A. �ζ���ˮ��Һ���ζ�����Ϊ50��ʱ��������Ũ�ȼ���ڹ�ϵ��c(NH4+)+c(H+)=c(OH-)
B. �ζ�����Ϊ100��ʱ����Ϊ�ζ������з�Ӧǡ����ȫ��ʱ��
C. �ӵζ����߿����жϣ�ʹ�ü�����Ϊ�ζ������е�ָʾ��ȷ�Ը���
D. �ζ���ˮ��Һ���ζ�����Ϊ150��ʱ��������Һ������Ũ���д�С��ϵc(Cl-)��c(H+)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com