
【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
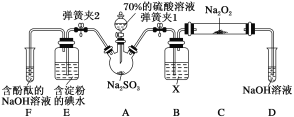
(1)关闭弹簧夹2,打开弹簧夹1,注入硫酸溶液至浸没三颈烧瓶中的固体。若将带火星的木条放在D试管口处,木条不复燃,说明SO2与Na2O2反应无O2生成,可能发生的化学方程式为____。
(2)关闭弹簧夹1,打开弹簧夹2,残余气体进入E、F中。E中的现象为___,E中反应的离子方程式为___。F中的现象为___。
【答案】Na2O2+SO2==Na2SO4 溶液蓝色褪去 SO2+I2+2H2O==2I-+SO42-+4H+ 红色变浅(或褪色)
【解析】
(1)过氧化钠具有氧化性,二氧化硫既有氧化性又有还原性,且属于酸性气体,根据过氧化钠和二氧化碳酸性氧化物之间的反应知道,过氧化钠可以和二氧化硫之间反应生成亚硫酸钠和氧气,但是氧气能将亚硫酸钠氧化为硫酸钠,所以可能发生的化学反应方程式为: Na2O2+SO2===Na2SO4;
(2)E中的离子方程式为:![]() ,该反应中二氧化硫为还原剂,碘离子为还原产物,氧化还原反应中,还原剂的还原性强于还原产物,能说明
,该反应中二氧化硫为还原剂,碘离子为还原产物,氧化还原反应中,还原剂的还原性强于还原产物,能说明![]() 还原性弱于
还原性弱于![]() ,现象为:E中溶液蓝色褪去;酚酞在碱性溶液中为红色,F中反应为
,现象为:E中溶液蓝色褪去;酚酞在碱性溶液中为红色,F中反应为![]() ═
═![]() ,碱性减弱,所以F中红色变浅或褪色。
,碱性减弱,所以F中红色变浅或褪色。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】等量的Al分别加入0.3 L 1 mol·L-1的盐酸和NaOH溶液中,生成氢气的体积比为1∶2,则加入Al的质量为( )
A.2.7 gB.5.4 gC.8.1 gD.10 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示:
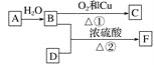
(1)写出决定B、D性质的重要原子团的名称:
B________、D________。
(2)A的结构式为____________。
(3)写出下列反应的化学方程式并注明反应类型:
①______________________,反应类型:_______;
②_________________,反应类型:________。
(4)实验室怎样区分B和D?___________。
(5)除去F中少量B和D的最好试剂是________(填字母)。
A 饱和碳酸钠溶液 B 氢氧化钠溶液 C 苯 D 水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容密闭容器中,进行反应COS(g)+H2(g) H2S(g)+CO(g)。下列说法中能说明反应已达到平衡状态的是:
A. c(COS)保持不变B. c(H2S)=c(H2)
C. 容器中气体密度保持不变D. v(H2)=v(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系为元素周期表中第ⅢB族、原子序数为5771的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________.
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____填元素名称)。
几种镧系元素的电离能(单位:kJmol-1)
元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
Yb (镱) | 604 | 1217 | 4494 | 5014 |
Lu (镥) | 532 | 1390 | 4111 | 4987 |
La (镧) | 538 | 1067 | 1850 | 5419 |
Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______(用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________(任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____,分子中所含化学键类型有 _______(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____个氧原子;已知晶胞参数为apm,密度为ρgcm-3,NA=_______(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:


(1)图1是依据氧化还原反应:Zn +Cu 2+=Zn 2++Cu 设计的原电池装置。
①电极X的材料是_____(填化学名称),反应过程中电极X的现象是_______。
②Y电极发生的电极反应式为:_______。
(2)图2是使用固体电解质的燃料电池,该燃料电池总反应方程式为:CH4+2O2 =CO2+2H2O。装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e― = 2O2-)。
①c电极为____极。(填“正”或“负”)
②B物质为______。
③d电极上的电极反应式为_______。
④固体电解质中O2-离子移向_______电极。(填“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是
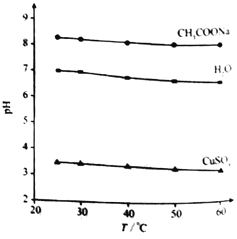
A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是:
A.1 L 0.1 mol·L-1亚硫酸钠溶液含有的SO32-数目为0.1NA
B.标准状况下,5.6L O2和O3的混合气体含有的氧原子数为0.5NA
C.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,转移电子的总数为NA
D.30g甲醛中含共用电子对总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置进行实验,下列说法错误的是
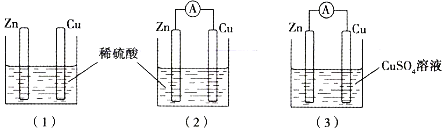
A. 若使图(1)装置中的Zn棒和Cu棒直接接触,则Cu棒上能看到有气体产生
B. 图(2)装置中SO42-向着Zn棒移动
C. 若将图(2)装置中Zn改为Mg,则Cu棒上产生气体的速率加快
D. 当图(2)装置与图(3)装置中正极生成物的质量比为1∶16时,两装置中Zn棒减轻的质量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com