
把1molA和3molB投入2L密闭容器中发生反应A(g)+3B(g)?2C(g)+D(s),2min后,测得C的浓度为0.2mol/L,则下列说法正确的是
A.v(D)=0.05mol/(L•min) B.3v(B)=2v(C)
C.v(B)=0.15mol/(L•min) D.A的转化率为40%
科目:高中化学 来源:2016-2017学年河北省邢台市高二上学期第四次月考化学卷(解析版) 题型:填空题
现有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,A原子的最外层电子排布式为1s1。B和D也属同一族,它们原子最外层的p能级与s能级的电子数之比是2∶1,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于s区的是_________(填元素符号)。
(2)由这五种元素组成的一种化合物是_________________________(填化学式)。
(3)写出D元素基态原子的最外层电子排布图:____________________。
(4)元素电负性:B__________D,元素第一电离能:C________E。(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省肇庆市高一上学期期末化学试卷(解析版) 题型:选择题
检验SO2中是否混有CO2,应采取的措施是
A.先通过Ba(OH)2溶液再通过石灰水
B.先通过酸性KMnO4溶液再通过石灰水
C.先通过小苏打悬浊液再通过石灰水
D.先通过澄清石灰水再通过品红溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:填空题
(1)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________(写表达式)。
2Ag+(aq)+ S2-(aq),其Ksp=____________(写表达式)。
(2)下列说法错误的是_______:
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
B.多数物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
C.对于Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
D.除去溶液中的Mg2+,用OH- 沉淀Mg2+ 比 用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大;
用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大;
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
(3)自然界原生铜的硫化物经氧化、淋滤作用后重生成CuSO4溶液,当这种溶液流向地壳深层遇到闪锌矿(ZnS)时,便会慢慢转化为铜蓝(CuS)[已知 Ksp(ZnS)=2.93×10-25、Ksp(CuS)=6.3×10-36],发生这种变化的原理是 。
(4)用右图装置,碱性条件下可以电解制备纳米Cu2O。反应为:2Cu+H2O Cu2O+H2↑,如下图所示。该电解池的阳极反应式为 。
Cu2O+H2↑,如下图所示。该电解池的阳极反应式为 。
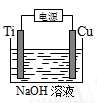
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:选择题
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值或性质中,前者大于或强于后者的是
A.溶液的导电性 B.醋酸的电离常数
C.完全中和时所需NaOH的量 D.H+的物质的量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:选择题
已知:CO(g)+2H2(g) CH3OH(g) △H,反应过程中生成1mol CH3OH(g)的能量变化如 右下图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是
CH3OH(g) △H,反应过程中生成1mol CH3OH(g)的能量变化如 右下图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是
A.加入催化剂,△H变小
B.△H=+91 kJ/mol[
C.生成1molCH3OH(l)时,△H值增大
D.反应物的总能量大于生成物的总能量
查看答案和解析>>
科目:高中化学 来源:2017届吉林长春外国语学校高三上期末化学试卷(解析版) 题型:实验题
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验:

Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、250mL容量瓶外,还必须有 。(填仪器名称)
(2)溶解混合物时,加入盐酸的作用是 ;操作II中加入氯水的作用是 ;
(3)写出过量氨水参加反应的离子方程式 ;
(4)将沉淀物置于坩埚中灼烧至质量不再减少后冷却至室温,坩埚质量是b g,坩埚与加热后固体总质量是c g,则样品中铁元素的质量分数是 ;
Ⅱ.有同学提出,还可以采用以下方法来测定

(5)加过量还原剂可否用铁粉 ;
(6)若用酸性 KMnO4溶液滴定含Fe2+的溶液,写出反应的离子方程式 ;
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:

(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)。[来
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
(3)某温度下Ksp[ Mg(OH)2] = 2×10 -11,若该温度下某MgSO4溶液里c(Mg 2+) =0.002 mol·L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于 ;该温度 下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分 析该溶液遇酚酞呈红色原因时,
析该溶液遇酚酞呈红色原因时, 甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。
甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。 请你设计一个
请你设计一个 简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数,下列说法正确的是
A.3.2gO2和O3的混合物中含有的氧原子数目为0.2NA
B. 的醋酸溶液中含有氢离子数目为0.1NA
的醋酸溶液中含有氢离子数目为0.1NA
C.标准状况下,2.24LCCl4含碳原子数目为0.1NA
D.将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com