
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:选择题
下列有关实验及现象、原理的描述正确的是
A.光照条件下,甲烷通入氯水中,发生了取代反应使黄绿色变浅
B.乙烯能使酸性高锰酸钾溶液褪色,也能使溴水褪色,两者反应原理一样
C.乙醛与新制氢氧化铜溶液混合好后,加热,得到砖红色沉淀
D.将一小 粒钠投入盛有无水乙醇的小烧杯中,有气泡产生,比钠在水中的反应更剧烈
粒钠投入盛有无水乙醇的小烧杯中,有气泡产生,比钠在水中的反应更剧烈
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:填空题
由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)  CH3OH(g) +H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g) +H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+ H2(g)  CO (g)+H2O(g) △H2
CO (g)+H2O(g) △H2
反应Ⅲ:CO(g)+2 H2(g)  CH3OH(g) △H 3=-90.77 kJ•mol-1
CH3OH(g) △H 3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅲ自发进行条件是 (填“低温”、“高温”或“任何温度”)。
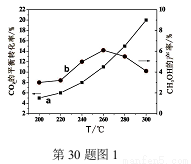
(2)某研究小组将一定量的H2和CO2充入恒容密闭容器中,在合适的催化剂条件下发生了反应I、Ⅱ、Ⅲ,不同温度下体系达到平衡时测得CO2的转化率(a)及CH3OH的产率(b)变化如图1所示。
①该反应达到平衡后,为再提高反应速率同时提高甲醇的生成量,可采取的措施有 。
A改用高效催化剂 B升高温度 C缩小容器体积 D分离出甲醇 E增加CO2的浓度
②据图1,当温度高于260℃时,CO2的平衡转化率随温度的升高继续增加,而CH3OH的产率却反而下降,请说明理由 。
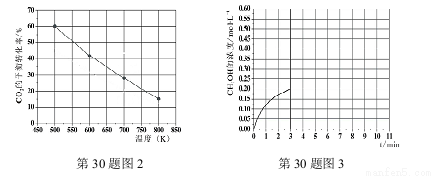
(3)已知:在2L恒容密闭容器中充入3mol H2和1.5mol CO2(一定条件下,仅考虑发生反应Ⅰ),实验测得在不同温度下,反应体系中CO2的平衡转化率与温度的关系曲线如图2所示。实验测得:在500K时,反应Ⅰ经10min时达到平衡,假如其他条件不变,当反应时间进行到3min时,迅速将反应温度升至600K进行实验,请在图3中画出3~10min内容器中CH3OH浓度的后续变化总趋势图。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
B.往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-=NH3↑+H2O
C.往酸性碘化钾溶液中滴加适量的双氧水:2I﹣+2H++H2O2=I2+2H2O
D.金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
下列与盐类水解无关的是
A.明矾可用作净水剂
B.热的纯碱溶液可用于除去物品表面的油污
C.铵态氮肥和草木灰(主要成分碳酸钾)不能混合使用
D.配制FeCl2溶液时需要向溶液中加少量铁粉
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期中质检化学试卷(解析版) 题型:选择题
在25 ℃时,将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶于水中制得1 L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是( )
A.该溶液的pH小于7
B.c(CH3COOH)+c(CH3COO-)=0.20 mol·L-1
C.c(CH3COOH)<c(CH3COO-)
D.c(CH3COO-)+c(OH-)=0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期中质检化学试卷(解析版) 题型:选择题
已知温度T0C时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与
b mol·L-1的一元碱BOH等体积混合,可判定该混合液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江哈尔滨六中高三上学期期末化学卷(解析版) 题型:填空题
I.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6) 表示:在1 min时H2的物质的量是6 mol。
表示:在1 min时H2的物质的量是6 mol。
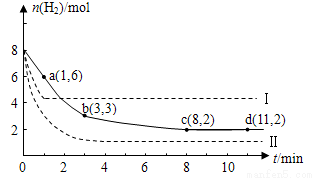
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。计算其化学平衡常数K=
(2)下列时间段平均反应速率最大的是
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)锰酸锂、钛酸锂都是绿色环保新型能源材料,可以用MnO2为原料制取锰酸锂。
①以石墨为电极,电解酸化的MnSO4溶液可制备MnO2,则阳极的电极反应式为 。
②MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三高补班12月月考化学卷(解析版) 题型:选择题
A、B、C、D、E是同周期的五种主族元素。A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A;C和D的最高价氧化物对应的水化物均呈酸性,且酸性C>D,E是这五种元素中原子半径最小的元素,它们的原子序数由小到大的顺序是( )。
A. A<B<C<D<E B. C<D<A<B<E
C. B<A<D<C<E D. E<C<D<B<A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com