
��Դ�Ŀ������������������Ŀɳ�����չϢϢ��أ�������ú���Դ�ǰ���������ǰ���ش���⡣
����֪����Fe2O3(s)��3C(ʯī)��2Fe(s)��3CO(g) ��H��a kJ��mol��1
��CO(g)��l/2O2(g)��CO2(g) ��H��b kJ��mol��1
��C(ʯī)��O2(g)��CO2(g) ��H��c kJ��mol��1
��Ӧ4Fe(s)��3O2(g)��2Fe2O3(s)���ʱ䦤H�� kJ��mol��1��
������ԭ��صĹ���ԭ�������л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص��� �������)��
A��C(s)��CO2(g)��2CO(g) ��H��0 B��NaOH(aq)��HCl(aq)��NaCl(aq)��H2O(l) ��H��0
C��2H2O(l)��2H2(g)��O2(g) ��H��0 D��CH4(g)��2O2(g)��CO2(g)��2H2O(l) ��H��0
����ϡ����Ϊ�������Һ�����ԭ��ص�������ӦʽΪ ��
��������Ϊһ����ɫ��Դ����������������뷢չ����ʮ����Ҫ�����塣
��1��ʵ���ã���ͨ������£�1 g H2��ȫȼ������Һ̬ˮ���ų�142.9 kJ��������H2ȼ�յ��Ȼ�ѧ����ʽΪ ��
��2���������ϳɰ����Ȼ�ѧ����ʽΪN2(g)��3H2(g)  2NH3(g) ��H����92.4 kJ��mol��1
2NH3(g) ��H����92.4 kJ��mol��1
��һ�������£�������������˵���÷�Ӧ�Ѵ�ƽ��״̬���� ��
A������(N2)������(NH3)
B�������ʵ����ʵ������
C�������������ʵ������ٱ仯
D�����������ܶȲ��ٱ仯
����ͼ��ʾ�ϳɰ���Ӧ�ﵽƽ���ÿ��ֻ�ı��¶ȡ�ѹǿ�������е�ijһ��������Ӧ���ʦ���ʱ��t�Ĺ�ϵ�����б�ʾƽ�������е�NH3�ĺ�����ߵ�һ��ʱ���� ��ͼ��t3ʱ�ı������������ ��

���¶�ΪT��ʱ����4a mol H2��2a mol N2����0.5 L�ܱ������У���ַ�Ӧ����N2��ת����Ϊ50%����Ӧ��ƽ�ⳣ��Ϊ ��
��. 6c��6b��2a ��. D O2��4H+��4e��=2H2O
��.��1��2H2(g) +O2(g)
= 2H2O(l) ��H=��571.6kJ/mol ��2���� C ��t2~t3 �����¶�
��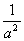 (mol/L)-2
(mol/L)-2
��������
�����������(��+��)��6-�١�2�÷�Ӧ4Fe(s)��3O2(g)��2Fe2O3(s)���ʱ䦤H��(6c��6b��2a )kJ/mol. ��.���ܹ���ԭ��أ���Ӧ����Ϊ������ԭ��Ӧ����Ϊ���ȷ�Ӧ��ֻ��D��������������ϡ����Ϊ�������Һ�����ԭ��ص�������ӦʽΪO2��4H+��4e��=2H2O�������ĵ缫ʽΪCH4-8e-+2H2O= CO2+8H+����1��H2ȼ�յ��Ȼ�ѧ����ʽΪ2H2(g) +O2(g) = 2H2O(l)
��H=��571.6kJ/mol����2����A�����κ�ʱ�̦���(N2)������(NH3)=1:2������(NH3)=2����(N2)��������(N2)=����(NH3)�������(NH3)=2����(NH3)����Ӧδ�ﵽƽ�⡣����B. �����ʵ����ʵ������,��ʱ���Ƿ�Ӧ��һ�����������������ܴﵽƽ�⣬Ҳ����Ϊ�ﵽƽ�⡣����C. �������������ʵ������ٱ仯��˵���κ����ʵ����ĵ�Ũ���������Ũ�Ȳ��䣬��Ӧ�ﵽƽ�⡣��ȷ��D�����������ݻ����䣬�κ�ʱ�̻��������ܶȲ��ٱ仯������˵����Ӧ�ﵽƽ�⡣������Ϊ��ѹ���������������ܶȲ��ٱ仯��˵����Ӧ�ﵽƽ�⡣��Ӧ������������ʲ���˵����Ӧ�Ƿ�ﵽƽ�⡣���ڴ�t0��t1��Ӧƽ�⣬��t1ʱ������ѹǿ��V����V��������V������ö࣬ƽ�������ƶ�����t2ʱ�̴ﵽ�µ�ƽ��״̬����t2��t3���ָ�ƽ�⣻��t3ʱ�������¶ȣ�V����V��������V������ö࣬ƽ�������ƶ����ﵽt4ʱ�̴ﵽ��һ���µ�ƽ��״̬����t4��t5���ָ�ƽ�⣻��t5ʱ�̼��������V����V�����������������ͬ��ƽ��û�з����ƶ������Ա�ʾƽ�������е�NH3�ĺ�����ߵ�һ��ʱ����t2��t3��ͼ��t3ʱ�ı�������������¶ȡ����ڷ�Ӧ��ʼ��n(H2)=4amol,n(N2)=2amol,����ƽ��ʱN2��ת����Ϊ50%�����Դ�ʱn(N2)=1amol ; n(H2)=amol,n(NH3)=2amol.
��Ӧ��ƽ�ⳣ��Ϊ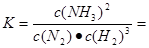
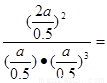
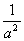 (mol/L)-2.
(mol/L)-2.
���㣺�����˹���ɵ�Ӧ�á��Ȼ�ѧ����ʽ����д����ѧƽ��״̬���жϡ����������ƽ���Ӱ�켰��ѧƽ�ⳣ���ļ����֪ʶ��


 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ܼ��������ǵ�����ϢϢ��أ�������ܼ�����ÿһλ����Ӧ�����������оٴ벻������һҪ����ǣ�������
���ܼ��������ǵ�����ϢϢ��أ�������ܼ�����ÿһλ����Ӧ�����������оٴ벻������һҪ����ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
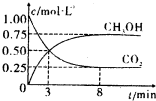 ��2012?��ׯ��ģ��̼��̼�Ļ����������������������е�Ӧ�÷dz��㷺����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�
��2012?��ׯ��ģ��̼��̼�Ļ����������������������е�Ӧ�÷dz��㷺����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�| n(H2) | n(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��1�����øĽ�������ɵİ취���������͵�ȼ�����ܣ����磬����CH3OC��CH3��3����������Ǧ���͡���CH3OC��CH3��3�����бش��ڵ�ԭ�Ӽ�������ʽ�� �� �� ����д��š���ѡ���ۣ��� |
| ��2����Ȼ����ȼ�ղ�������Ⱦ����ֵ�ߡ��ܵ����ͷ��㣬��Ȼ������Ϊ�ҹ������������ص�֮һ����Ȼ������ʯ�Ͱ���������Ҫ�ɷ��� ���飨��CH4�� ���飨��CH4�� ����˵�����������������������ƽ��ṹ���������� �� ����д��š���ѡ���ۣ��� ����һ�ȴ��ﲻ����ͬ���칹�壻 ������ȴ��ﲻ����ͬ���칹�壻 ��̼ԭ������ԭ��֮���Թ��ۼ���ϣ� ���ĸ�̼�������ȫ�ȼ۵ģ� ��3��1980���ҹ��״��Ƴ�һ��ȼ����������Ա12 �ˣ���50 km/h���ٶ���ʻ��40 km��Ϊ����Ч��չ��������Դ�����ȱ����Ƶ����۵�����������ɹ������ֽϾ��õ����ⷽ���� �� �� ����д��š���ѡ���ۣ��� �ٵ��ˮ����п��ϡ���ᷴӦ���۹�⺣ˮ�� ��Σ��Ƶ���������Ҫ����������� ���������ͺ����� ���������ͺ����� ��д������һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09-10����̨���и�һ��ѧ�ڵ�Ԫ���ԣ��ģ���ѧ�� ���ͣ������
��10�֣�����ʯ�ͼ۸��ǣ���Ч������������Դ�Ϳ�������Դ���ܵ��������ձ����ӡ�
��1�����øı�������ɵİ취���������͵�ȼ�����ܣ��������CH3OC��CH3��3��������Ǧ���͡���CH3OC��CH3��3�����бش��ڵ�ԭ�Ӽ��������ʽ��_______����д��ţ���




��2����Ȼ����ȼ�ղ���������ֵ�ߡ��ܵ����ͷ��㣬����Ϊ�ҹ������������ص�֮һ����Ȼ������ʯ�Ͱ���������Ҫ�ɷ���__________����˵�����������������������ƽ��ṹ��������___________����д��ţ�
�� ��һ�ȴ��ﲻ����ͬ���칹�� �� ����ȴ��ﲻ����ͬ���칹��
�� ̼ԭ������ԭ��֮���Թ��ۼ���� �� 4��̼�������ȫ�ȼ۵�
��3��1980���ҹ��״��Ƴ�һ��ȼ����������Ա12�ˣ���ÿСʱ50 km���ٶ���ʹ��40km��Ϊ����Ч��չ��������Դ�����ȱ����Ƶ����۵�����������ɹ������ֽϾ��õ����ⷽ����_______________����д��ţ���
�ٵ��ˮ �� п��ϡ���ᷴӦ �� ��⺣ˮ
�Ƶ���������Ҫ�����������_________________________��д������һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��08��ɳ������ѧ��ģ��(14��)I������Դ�Ŀ��������ǵ���ȫ���һ���ش��о����⣬��չ����Դ���Ź�����ǰ�������о���Ա����ˡ�����̫���ܣ���ˮΪԭ�ϣ������������������������ֻ�е�Ķ���ȼ�ϡ���һ���롣�Իش��������⣺
(1)����Ϊ��һ�����ܷ�ʵ�֣�___________��(��ܡ��������ܡ�)
(2)������Ϊȼ�������ڹ㷺ʹ�õĻ�ʯȼ�������ʲô�ŵ㣿(Ҫ��������)
��__________ _����__________ ��
(3)ȼ�ϵ����һ�����͵�����Ⱦ������������Ч�ʵķ����豸��Ҳ��һ�ֺ��з�չDZ��������Դ����ȼ�ϵ���У�������ȼ����ͨ�������¾����ڵ缫�Ͻ��е缫��Ӧ(һ���ö�������������缫����)������еĵ����Ϊ�л��߷��Ӹ߾�������Խ������ӣ�
��ȼ�ϵ�صĵ缫�ڳ��������¾��ܳ��������缫��Ӧ��д������ȼ�ϵ���еĵ缫��Ӧʽ������____________________________��
������ȼ�ϵ�ؿ���Ϊ���˺���������ѡ��أ���������Ϊȼ�ϵ�ص��ŵ��⣬����һ����Ҫԭ����__������������������������������������������������
II�����������ǵ��������ע���ȵ����⡣
(1)Ϊ�˽�������β���Կ�������Ⱦ������������ij����������������ʹβ���е�CO�뵪������(NO)��Ӧ��ת��Ϊ�����к��е���������(����һ��Ϊ����)���÷�Ӧ�Ļ�ѧ����ʽΪ__________������������������������������
(2)���ٽ�CO2������һ����ˮ���ơ�����ȼ���ܽ�����ǿ���ܼ�������Ϊ����ɫ�����ܼ���������Ϊ����ɫ�����ܼ�����ԭ��֮һ��:�ܴ��������к����ж�����ȼ���л��ܼ���֮����_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com