
���¹���ﮡ��ơ��ء�﨡�蘆���������ȷ����( )
�����������м�����ǿ����CsOH�� �ڵ����۵���ߵ���藍�
����O2��Ӧ���ɵõ���������� �����ǵ��ܶ���������Ҫ������ú���У�
���䵥�ʵĻ�ԭ��������ǿ�� �����Ƕ�Ӧ���ӵ�������������ǿ��
�ߵ�����ˮ��Ӧ�ľ��ҳ̶��������ӣ��������ͬŨ�ȡ���ͬ�����������Һ��Ӧ�ľ��ҳ̶���������
A. �٢ݢߢ� B. �ڢ�� C. �ڢۢܢ� D. �ڢۢ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ��ͨ�и����߿�ȫ��ģ�⣨һ����ѧ�Ծ��������棩 ���ͣ������
������þ����֪��;�㷺�����߿���ǰ���Ļ������ϣ��㷺Ӧ������ȼ����ˮ�к͡���������ȷ��档þ�����ο�ʯ[��Ҫ�ɷ�Mg3Si2O5(OH)4����������������������������������]����������������þ����Ҫ�����������£�

��֪�����ֽ��������ӵ������������ʱ��pH���±���ʾ��
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
��ʼ����ʱ | 1.5 | 3.3 | 6.5 | 9.4 |
������ȫʱ | 3.7 | 5.2 | 9.7 | 12.4 |
��1���Կ�ʯ���յ�Ŀ����_______________________��
��2������H2O2��Һ��Ӧ�����ӷ���ʽ��___________________��
��3������Һ���м����X������______________��������______________��
��4�����백ˮʱ��Mg2+ת�������¶�t�ı仯��ͼ��ʾ��

����Һ���з�����Ӧ�����ӷ���ʽ��__________________��
��t1ǰMg2��ת���������ԭ����__________________��t1��Mg2��ת�����½���ԭ���ǣ��û�ѧ����ʽ��ʾ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и�һ��ѧ�ڵ�һ���¿���3�£���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ�Dz��ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵͼ������˵����ȷ���ǣ� ��

A. ԭ�Ӱ뾶��Z��Y��X
B. ��̬�⻯����ȶ��ԣ�W��R
C. W����������Ӧ��ˮ������ǿ��
D. Y��Z��������������Ӧ��ˮ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ĵ�ʡ�ɶ��б���У��2016-2017ѧ���һ3���¿���ѧ�Ծ� ���ͣ�ѡ����
��ͼ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵͼ��������˵����ȷ����( )

A. X��M�γɵ�һ���������к���29������
B. ��̬�⻯��е�Y>R
C. ��X��N����Ԫ����ɵĻ����ﲻ�����κ��ᷴӦ��������ǿ�Ӧ
D. Z�����ܴ�M��RԪ�ع��ɵ�����Һ���û�������M
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ĵ�ʡ�ɶ��б���У��2016-2017ѧ���һ3���¿���ѧ�Ծ� ���ͣ�ѡ����
�����������ѧ�Ŀ�ѧ�һ���˼��������о������N4���ӣ�N4���ӽṹ����ͼ��ʾ�������й�N4��˵����ȷ����( )
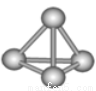
A. N4��һ�����͵Ļ����� B. N4������ֻ���зǼ��Լ�
C. N4�ķе��P4�����ף��� D. 1mol N4�к���9 mol���ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ȫ���¿γ̸߿�������Ϣ���ۣ�һ����ѧ�Ծ��������棩 ���ͣ������
��ѧ��Ӧԭ���ڹ�ҵ�������й㷺��Ӧ�á�
(1)��ҵ�ϳɰ�����������Ҫ������Ȼ����ˮ�ķ�Ӧ, ������ԭ�����к���CO���ʣ���ҵ������ͨ�����з�Ӧ��ʵ��ԭ������CO�ij�ȥ��
CO(g)+H2O(g) CO(g)+ H2(g) ��H<0��һ�������·�Ӧ�ﵽƽ����ȡ_____��ʩ�����CO��ת���ʡ����ݻ�Ϊ2L�������з���������Ӧ������c(CO2)�뷴Ӧʱ��(t)�Ĺ�ϵ��ͼ����ʾ����t0ʱ�̽��������������4L����ͼ���л���t0ʱ�̺�c(CO2)�뷴Ӧʱ��(t)�ı仯����_____��
CO(g)+ H2(g) ��H<0��һ�������·�Ӧ�ﵽƽ����ȡ_____��ʩ�����CO��ת���ʡ����ݻ�Ϊ2L�������з���������Ӧ������c(CO2)�뷴Ӧʱ��(t)�Ĺ�ϵ��ͼ����ʾ����t0ʱ�̽��������������4L����ͼ���л���t0ʱ�̺�c(CO2)�뷴Ӧʱ��(t)�ı仯����_____��

(2)��������Ҫ��;�Ǻϳ�����. �����ϱ�n(NH3)/n(CO2)=4ʱ��CO2��ת���ʱ仯��ͼ����ʾ��a��v(CO2)��______��v(CO2)��(����ڡ�����С�ڡ����ڡ�)��NH3��ƽ��ת������______��
(3)ij����С������CO��H2���ܱ������з�Ӧ�ϳɼ״���ʵ�飬�����Ŀ�ʼ�����VL��ʵ�����������м���CO nmol, H22nmol����һ����ѹǿ�ʹ����������·�Ӧ��CO (g)+ 2H2(g) CH3OH(g)����ͼΪ��Ӧ�ﵽƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ���ش��������⡣
CH3OH(g)����ͼΪ��Ӧ�ﵽƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ���ش��������⡣
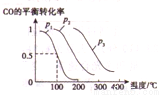
�������ϳɼ״��ķ�Ӧ��______(�� �����ȡ����ȡ�)��Ӧ��ͼ���е�ѹǿp1��p2��p3�Ĵ�С��ϵ��_______��
����ͼ�����ѹǿp1�¶���100��ʱ�ϳɼ״���Ӧ��ƽ�ⳣ��K=_______��
����ѹǿ��p1�¶���100��������£���ʼ���������м���CO 2nmol��H24nmol����Ӧ�ﵽƽ��ʱCO��ת����_____(��������С�����䡱)��ƽ��ʱCO�����ʵ���_____(����ڡ�����С�ڡ����ڡ�)nmol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ȫ���¿γ̸߿�������Ϣ���ۣ�һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
���������������
A. ��ϩ�ͱ�����ʹ��ˮ��ɫ����ɫ��ԭ����ͬ
B. ���ۡ���֬�������ʶ���ˮ�⣬��ˮ����ﲻͬ
C. �Ҵ�������������������ñ���Na2CO3��Һ����
D. �Ҵ������ᡢ�����������ܷ���ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��߿���Ϣ����ȫ����I�������ۺϣ�һ����ѧ�Ծ��������棩 ���ͣ������
�״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶� | |
500 | 800 | ||
��2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) | K2 | 1.00 | 2.5 |
��3H2(g)+CO2(g) | K3 | ||
(1)�����һ�����ܱ������з�����Ӧ�ڣ��ﵽƽ��������¶ȣ�����˵����ȷ����____________
A.ƽ�������ƶ� B.�ﵽ�µ�ƽ�����ϵ��ѹǿ����
C.H2��ת�������� D.��ϵ���ܶ�����
(2)ij�¶��·�Ӧ����H2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ������ʼ����2molH2��1molCO��A��ʱ���������Ϊ1L����B��Ļ�ѧƽ�ⳣ��Ϊ_______��

(3)�ݷ�Ӧ����ڿ��Ƶ���Kl��K2��K3֮��Ĺ�ϵ����K3=__________��(��K1��K2��ʾ)��500��ʱ��÷�Ӧ����ijʱ�̣�H2(g)��CO2(g)��CH3OH(g)��H2O(g) ��Ũ��(mol/L)�ֱ�Ϊ0.8��0.1��0.3��0.15,���ʱv��_______ v��(�> ������= ����< ")��
(4)��3L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪c(CO)һ��Ӧʱ��t�仯����l��ͼ��ʾ������t0ʱ�̷ֱ�ı�һ������������I��Ϊ����II������III��

������I��Ϊ����IIʱ���ı������������________��������I��Ϊ����IIIʱ���ı������������___________��
(5)һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣͨ��״���£���a mol/L�Ĵ�����bmol/LBa (OH)2��Һ�������ϣ���Ӧƽ��ʱ��2c(Ba2+)=c(CH3COO-)���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ��ͨ�и����߿�ȫ��ģ�⣨������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���20.00 mL 0.1000 mol��L-1 CH3COONa ��Һ����μ��� 0.100 0 mol • L-1���ᣬ��Һ��pH��������������Ĺ�ϵ����ͼ��ʾ(�����ǻӷ�)������˵����ȷ����

A. CH3COONa��Һ�У�c(H+) +c(CH3COOH)=c(OH-)+c(Na+)
B. �����ʾ��Һ��:c(CH3COOH) =c(Cl-)>c(OH-)=c(H+)
C. �����ʾ��Һ��:c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+) >c(OH-)
D. �����ʾ��Һ��:c(Na+)= c(Cl-)>c(CH3COOH) >c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com