
工业上常利用CO与SO2反应生成固态S单质和CO2,从而消除这两种气体对大气的污染:2CO(g)+SO2(g) 2CO2(g)+S(s) ΔH=-a kJ/mol(a>0),下列叙述正确的是
2CO2(g)+S(s) ΔH=-a kJ/mol(a>0),下列叙述正确的是
A. 该反应的平衡常数表达式为
B. 若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ
C. 增大压强或升高温度都可以加快化学反应速率并提高SO2的转化率
D. 若单位时间内生成2 mol CO2,同时消耗1 mol SO2,则说明反应达到平衡状态
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列仪器名称为“分液漏斗”的是
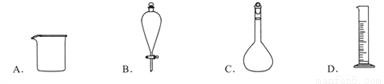
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:实验题
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
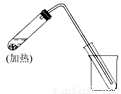
(1)左边大试管中要加入几片碎瓷片,其作用是_________________________________;
(2)该装置中使用的玻璃导管较长,其作用是____________________________________;
(3)烧杯中还要盛有的物质是________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
①烧杯②坩埚③蒸发皿④试管⑤蒸馏烧瓶⑥锥形瓶⑦燃烧匙
A. ①⑤⑥ B. ③⑥⑦ C. ①⑤ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
在0.1 mol·L-1的NaHCO3溶液中,下列关系正确的是
A. c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B. c(Na+)=c(HCO3-)>c(OH -)>c(H+)
-)>c(H+)
C. c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
D. c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
下列说法可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的 同时,有6个N-H键断裂
同时,有6个N-H键断裂
②v(H2)=0.6 mol·L-1·min-1,v(NH3)=0.4 mol·L-1·min-1
③保持其他条件不变时,体系压强不再改变
④NH3、N2、H2的体积分数都不再改变
⑤恒温恒容时,混合气体质量保持不变
A. ②③④ B. ①③④ C. ①②④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A. 升高温度 B. 加入一种反应物 C. 增大压强 D. 使用催化剂
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三3月高考适应性测试理综化学试卷(解析版) 题型:简答题
消除氮氧化物污染对优化空气质境至关重要。
(1)用CH4催化还原氮氧化物消除氮氧化物的污染发生的反应如下:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO2(g) 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用0.2molCH4将NO2还原为N2,则整个过程中放出的热量为________kJ。(假设水全部以气态形式存在)
(2)用活性炭可处理大气污染物NO。在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当沮度分别在T1和T2时.测得反应达到平衡时各物质物质的量如下表;
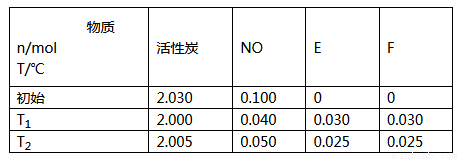
①请结合上表数据.写出NO与活性炭反应的化学方程式_______________。
②T1℃ 时,上述反应的平衡常数的值为________。如果已知T2>T1,则该反应正反应的△H___(填“>”“<”或“=”)0
③ 在T1温度下反应达到平衡后,下列措施不能增大NO转化率的是_______。
a.降低温度 b.增大压强 c.增大c(NO) d.移去部分F
(3)汽车尾气处理中的反应有2NO+2CO 2CO2+N2。某温度时,在1L密闭容器中充入0.1molCO和0.1mol NO,5s时反应达到平衡,测得NO的浓度为0.02mol/L,则反应开始至平衡时,NO的平均反应速率v(NO)=________。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol/L、amol/L、0.01mol/L、0.04mol/L,要使反应向正反应方向进行,a的取值范围为_____________。
2CO2+N2。某温度时,在1L密闭容器中充入0.1molCO和0.1mol NO,5s时反应达到平衡,测得NO的浓度为0.02mol/L,则反应开始至平衡时,NO的平均反应速率v(NO)=________。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol/L、amol/L、0.01mol/L、0.04mol/L,要使反应向正反应方向进行,a的取值范围为_____________。
(4)某课题组利用下图所示装置,探究NO2和O2化合生成N2O5形成原电池的过程。物质Y的名称为_______,该电池的正极反应式应为___________。

查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
工业上生产氮化硅陶瓷反应为3SiCl4+2N2+6H2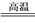 Si3N4+12HCl,有关该反应说法正确的是
Si3N4+12HCl,有关该反应说法正确的是
A. SiCl4是氧化剂 B. N2失电子 C. H2被还原 D. N2发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com