
(本题16分)工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________ ________
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
①脱氢反应的△H_____0,600K时,Y点甲醇的υ(正) _____υ(逆)(填“>”或“<”)
②从Y点到X点可采取的措施是_______________________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由__________________________________________________________________________。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3-OH的脱氢实验:
CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol (2分)
(2)①> (2分)②< (2分)
②降低温度和增大压强(2分)
③不正确(1分)。因为当CH3OH的起始浓度不同时,其转化率就不等于90%。(1分)
(3)7.0×10-5 mol·L-1 min-1(2分) <(1分) <(1分)
(4)CH3-OH + 8OH- + 6e- = CO32- + 6H2O (2分)
解析试题分析:
(1)根据题意,先写出甲醇不完全燃烧生成一氧化碳和液态水的化学方程式,标明状态,再根据盖斯定律求算焓变。
(2)①由坐标图可知,随着温度的升高,甲醇的平衡转化率在不断地增大,即是温度升高,平衡向正反应方向移动,所以焓变大于0;②Y点在曲线的上方,在该温度下,平衡转化率应比Y点小,所以平衡当向逆进行,才能达到X点,所以正反应速率小逆反应速率;可以采用降温或增大压强的方法;③不正确,起始浓度不一样,转化率就不同了。
(3)审清题意“实验①的前20 min,ν(H2)”,ν(H2)=(0.050-0.0486)mol·L-1/20min
;该反应是吸热反应,比较实验①和实验②达到平衡所需要的时间,便可判断温度的高低和催化剂的催化效果;
(4)负极发生的是氧化反应,所以先把这一部分CH3-OH -6e- → CO32-写出来,因为电解质溶液是碱性的,C以CO32-存在,由电荷守恒可知,左边当再加上OH-,右边加上H2O,配平就可以了。
考点:热化学方程式的书写;影响化学平衡的因素;化学平衡常数的应用;化学反应速率的计算;电化学电极反应式的书写。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
下列关于判断过程的方向的说法正确的是( )
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
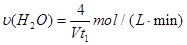
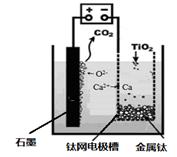
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ ·mol-1 | 436 | 498 | X |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的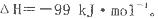 。请回答下问题;
。请回答下问题;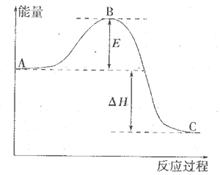
(1)E表示___________________;E的大小对该反应的反应热__________(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中△H___________(填“变大”、“变小”或“不变”),理由是________。
(3)已知单质硫的燃烧热为296 kJ·mol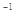 ,计算由S(s)生成2mol SO3(g)的△H =________________。
,计算由S(s)生成2mol SO3(g)的△H =________________。
(4)在一定条件下向容积为2L的容器中通入4molSO2和3molO2,充分反应达平衡后,SO3的体积分数为1/3。若在相同的条件下向容积为2L的容器中通入amolSO2和,bmolSO3,和cmol,反应向逆反应方向进行且达到平衡时SO3的体积分数也为1/3。则c的取值范围为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
;实验a和c的平衡转化率:αa为 、αc为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
② H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+  O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) ===2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s) ===2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
则2Fe2O3(s)+3C(s) ===4Fe(s)+3CO2(g) ΔH= kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g) ===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com