
【题目】美国Lawrece Liermore国家实验室(LINL)成功地在高压下将![]() 转化为具有类似
转化为具有类似![]() 结构的原子晶体,下列关于
结构的原子晶体,下列关于![]() 的原子晶体说法,正确的是:
的原子晶体说法,正确的是:
A. ![]() 的原子晶体和分子晶体互为同分异构体
的原子晶体和分子晶体互为同分异构体
B. 在一定条件下,![]() 原子晶体转化为
原子晶体转化为![]() 分子晶体是物理变化
分子晶体是物理变化
C. ![]() 的原子晶体和
的原子晶体和![]() 分子晶体具有相同的物理性质和化学性质
分子晶体具有相同的物理性质和化学性质
D. 在![]() 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
科目:高中化学 来源: 题型:
【题目】工业烧碱中常含氯化钠等杂质。
(1)简述检验工业烧碱中含有氯化钠的实验方法___;
(2)写出一种工业烧碱中还可能含有的杂质的化学式___;
(3)某同学采用硝酸银将离子沉淀的方法测定工业烧碱的纯度,取ag样品,经一系列操作,分离并称得氯化银的质量mg,则氢氧化钠纯度计算式为__。已知该测定结果偏低,可能的原因是__;
A.未将氢氧化钠去除 B.氯化银颗粒细小,难以过滤
C.氯化银部分分解 D.氯化银沉淀未洗涤干燥
(4)粗盐提纯过程中,除去硫酸根离子可选用的试剂是__;
A.氯化钡 B.氢氧化钡 C.硝酸钡 D.盐酸
(5)氯化钾的熔点低于氯化钠,从物质结构的角度加以解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“张亭栋研究小组”受民间中医启发,发现As2O3对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)为第VA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
(1)N原子的价电子排布式为___,N、P、As原子的第一电离能由大到小的顺序为___。
(2)NH3的沸点比AsH3的沸点高,原因是_____。
(3)立方氮化硼晶体(BN),是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
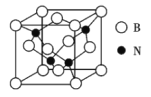
立方氮化硼是____晶体,晶体中N原子的杂化轨道类型为___,B原子的配位数为______。
(4)若立方氮化硼晶胞的边长为362 pm,则立方氮化硼的密度为____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
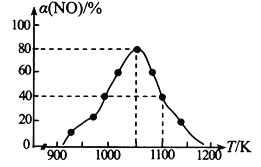
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。

(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙66具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应用于汽车、电气等工业中。以下是生产尼龙66的一些途径。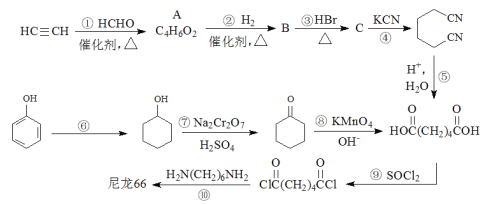
(1)A中所有碳原子都处于同一直线上,则A的结构简式为_____________。
(2)B的名称是_____________。
(3)反应①~④中,属于加成反应的有_____________,反应⑥~⑨中,属于氧化反应的有_____________。
(4)请写出反应⑥的化学方程式为_____________。
(5)高分子材料尼龙66中含有![]() 结构片段,请写出反应⑩的化学方程式为_____________。
结构片段,请写出反应⑩的化学方程式为_____________。
(6)某聚合物K的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物K的结构简式是_____________。
(7)聚乳酸( )是一种生物可降解材料,已知羰基化合物可发生下述反应:
)是一种生物可降解材料,已知羰基化合物可发生下述反应: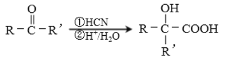 (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程_____________。
(R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①pH=7的溶液中:Fe3+、Cl-、Na+、NO3-
②pH=11的溶液中:CO32-、Na+、NO3-、S2-、K+
③水电离的H+浓度为10-12 molL-1的溶液中:NH4+、Na+、SO42-、HCO3-
④加入Mg能放出H2的溶液中:Mg2+、NO3-、NH4+、K+、S2O32-
⑤澄清溶液中:Na+、HCO3-、K+、AlO2-、SO42-
⑥![]() =1×10-12的溶液中:K+、Na+、CO32-、NO3-
=1×10-12的溶液中:K+、Na+、CO32-、NO3-
⑦水溶液中:K+、SO42-、NH4+、NO3-、HCO3-
A.①③⑤⑦B.①④⑤⑥C.②④⑤⑥D.②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在化合物中通常是Fe(Ⅱ)、Fe(Ⅲ),现有一定量固体物质A,可能由FeSO4、Fe2(SO4)3组成,通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设:该固体物质是FeSO4;或该固体物质是Fe2(SO4)3;或该固体物质是___。
(2)设计实验方案:取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如表:
实验方法 | 实验现象 | 结论 |
在溶液中加入KSCN溶液 | ___ | 固体物质中有Fe2(SO4)3 |
在酸性KMnO4溶液中加入少量A振荡 | KMnO4溶液颜色无明显变化 | 固体物质中不含___。 |
(3)若该固体A可能还存在铁,则不能证明固体物质中含___,其理由至少有两个,请分别用离子方程式表示___、___。
(4)![]() ,写出由“白色沉淀”转化为“红褐色沉淀”的化学方程式___。
,写出由“白色沉淀”转化为“红褐色沉淀”的化学方程式___。
(5)上述白色沉淀在空气中迅速变成灰绿色,最后变成红褐色,由此得出Fe(Ⅱ)的还原性强弱与___有关,FeSO4的还原性___Fe(OH)2(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷与氧气反应过程中的能量变化如下图所示。下列有关说法中正确的是

A. 反应 CO2(g)+2H2O(l)==CH4(g)+2O2(g) △H<0
B. 若将1mol CO2(g)、2 molH2O(l)的能量标在图中,则其位置在①、②之间
C. 若C一H键的键能为415kJ mol-1,则O= O的键能为493 kJ mol-1
D. 若该反应过程中转化的化学能为200kJ,则有0.25 molC=O生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com