
【题目】第四周期有18种元素,其相关化合物在化工、医药、材料等领域均有着广泛的应用。请回答下列问题:
(1)基态钙原子核外电子云形状为____________,电子占据的最高能层符号是____________。
(2)五氧化二钒(V2O5)是硫酸工业中重要的催化剂,基态钒原子的价电子排布式为____________。
(3)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,1molCN-中含π键的数目为____________,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是____________。
(4)镓、锗、砷、硒的第一电离能由大到小的顺序为____________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维渗杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为____________,中心原子的杂化类型为____________;砷酸酸性弱于硒酸,从分子结构的角度解释原因____________;砷化硼是一种新型材料,或成为最好的热导体,其结构与金刚石相似,已知砷化硼晶胞参数为bpm,则该晶体的密度为____________ g ·cm-3。(NA表示阿伏加德罗常数的值)。
【答案】 球形和哑铃形 N 3d3 4s2 2NA Fe3+的3d5半满状态更稳定 As>Se>Ge>Ga 分子晶体 sp3 硒酸中非羟基氧原子较多(或其他合理解释) 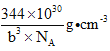
【解析】(1)基态钙原子核外电子排布式为1s22s22p63s23p64s2,由于s、p两个能级的电子云形状分别为球形和哑铃形,所以基态钙原子核外电子云形状为球形和哑铃形;电子占据的最高能层是第四层,符号是N;
(2)钒的原子序数为23,所以其基态的价电子排布式为3d3 4s2;
(3)在CN-内部有一个σ,两个π键,所以1molCN-中含π键的数目为2NA;Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,3d5是半充满状态,比较稳定,所以Fe2+易被氧化成Fe3+;
(4)同周期主族元素的第一电离能从左到右是依次增大的,但其中ⅡA和ⅢA,以及ⅤA和ⅥA之间存在有全满和半满的情况,所以有反常现象,因此镓、锗、砷、硒的第一电离能由大到小的顺序为As>Se>Ge>Ga;四氯化锗的熔沸点都很低,所以其晶体为分子晶体;中心原子即Ge的杂化类型为sp3,可以和四个氯原子形成四个等价的共价键;砷酸的分子式为H3AsO4,而硒酸的分子式为H2SeO4,所以在分子结构上,砷酸分子中的非羟基氧原子数少于硒酸的,所以砷酸酸性弱于硒酸;根据金刚石的晶胞结构可知,每个砷化硼晶胞中含有4个BAs分子,所以每个晶胞的质量m= ![]() ,其体积为V=(b×10-10)3 cm3,所以该晶体的密度为
,其体积为V=(b×10-10)3 cm3,所以该晶体的密度为![]()


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
A.分子式为C15H16O7
B.1 mol儿茶素A在一定条件下最多能与6 mol H2加成
C.等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应消耗金属钠和氢氧化钠的物质的量之比为1:1
D.1 mol儿茶素A与足量的浓溴水反应,最多消耗Br2 4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:
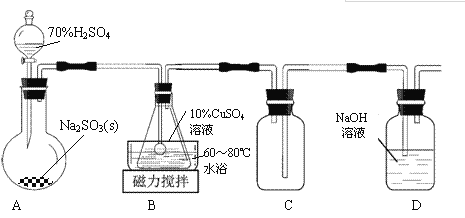
(1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是_______________。
(2)装置B中发生反应的离子方程式为_______________。
(3)装置C的作用是____________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
①检验洗涤已完全的方法是__________________。
②不用烘干的方式得到产品,其原因是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,_______________,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
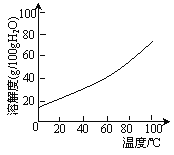
[已知:①该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8,8.8);Cu(OH)2(4.2,6.7);Fe(OH)3(1.1,3.2)。②在水溶液中超过100℃,硫酸铜晶体易失去结晶水。③硫酸铜晶体溶解度曲线如右图所示]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较顺序中,不正确的是![]()
A. 热稳定性:HF<HCl<HBr<HI B. 微粒半径:K+>Na+>Mg2+>Al3+
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 最外层电子数:Li<Mg<Si<Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是![]()
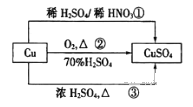
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2:3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mL
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和氯元素及其化合物与人类的生产、生活密切相关。
I.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
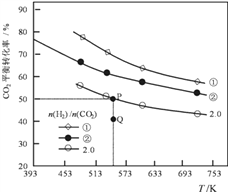
在三个容积均为1L的密闭容器中以不同的氢碳比n(H2)/n(CO2)充入H2和CO2,在一定条件下发生反应:
2CO2(g) + 6H2(g) ![]() C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
(1)反应的△H_____0,氢碳比①________②,Q点v(正)_____v(逆)(填“大于”或“小于”)
(2)若起始时,CO2的浓度为0.5mol/L,氢气的浓度为1.0mol/L;则P点对应温度的平衡常数的值为_____________________。
II.氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺[NH2Cl(g)],已知部分化学键的键能:
则上述反应的热化学方程式为_______________________________________________________。
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能/kJ·mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
_________________________________________________________。
III.用氨水除去SO2
(1)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol/L,则溶液中的c(OH-)=_________mol/L.将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=_____________.
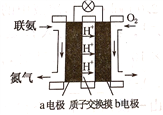
(2)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨-空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为____________极(填“正”或“负”),写出该电池工作时a电极的电极反应式___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
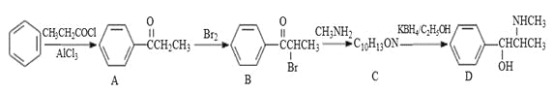
回答下列问题:
(1)伪麻黄碱(D)的分子式为 ;B中含有的官能团有 (写名称)。
(2)写出 B—C反应的化学方程式: 。C—D的反应类型为 。
(3)B的消去产物可以用于合成高分子化合物E,请写出 E的结构简式: 。
(4)满足下列要求的A的同分异构体有 种;
①能发生银镜反应
②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为 (写结构简式)。
(5)已知:![]() 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备![]() 的合成路线: 。
的合成路线: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃时,平衡常数K=1.现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硫酸铝酸性溶液制备可溶性的碱式硫酸铝[Ala(SO4)b(OH)c],并用它对烟气进行脱硫处理的过程如图1:
(1)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Ala(SO4)b(OH)c . 过滤时所用的玻璃仪器有、和烧杯,滤渣的主要成分为(填化学式).
(2)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”“减小”或“不变”).
(3)Ala(SO4)b(OH)c中a、b、c的代数关系式为 .
(4)已知在常温下溶液中Al3+、AlO2﹣的浓度与溶液pH的关系如图2所示.为确定碱式硫酸铝的组成,进行如下实验:
①取2.18g碱式硫酸铝样品在空气中灼烧至恒重,样品质量减少了0.36g.
②另取2.18g碱式硫酸铝溶于水,调节溶液的pH到5.0~7.8.
③将②产生的沉淀过滤、洗涤、灼烧至恒重,称量剩余固体为1.02g.
请计算样品中Al3+和SO42﹣的物质的量之比(写出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com