
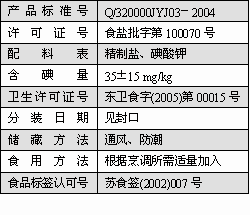
I、下表是如东某超市出售的“淮牌”加碘精制盐的有关说明:
II、下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在.碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源.目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在.通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等粘膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡.碘遇淀粉(面粉的主要成分)会出现明显的蓝色.碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2…………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2…………⑵
反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应.
根据以上信息,回答下列问题:
⑴反应⑴、反应⑵的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3=H++HSO3-)反应⑴:________;反应⑵:________;I2在反应⑴中是________(填“氧化”或“还原”,下同)产物,在反应⑵中是________产物;
⑵请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素.
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
2.________.
实验原理:(提示:结合题中信息和实验目的进行分析)________.
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)________.
实验步骤:(用准确、简洁的语言填写下表)

问题讨论:如东有100多km的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是如东人的主要副食品,如东人的食用盐中需要加碘吗?说明你的理由.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com