
固体A的化学式为NH5,它的所有原子的最外电子层结构都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数的数值)
B.NH5中既有共价键又有离子键
C.NH5的电子式为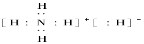
D.NH5与水反应的化学方程式为NH5+H2O = NH3·H2O+H2↑
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源:2016-2017学年湖南师范大学附属中学高一下学期第一次阶段性测试化学试卷(解析版) 题型:填空题
已知A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下图所示反应关系:

(1)如果A、B、C、D均是1O电子的粒子。请写出A的电子式:______,D的结构式:_____。
(2)如果A、C均是18电子的粒子,B、D均是10电子的粒子。A与B在溶液中反应生成C和D的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省凯里市高三3月联考理综化学试卷(解析版) 题型:实验题
辣椒中含辣椒素,局部应用可助减轻疼痛。辣椒素酯类化合物的结构可以表示为: (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:

已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰,峰面积比分别为9:1和3:1;
②化合物J的分子式为C15H22O4;
③
回答下列问题:
(1)G中含有的官能团有 、 。
(2)由C生成D的反应类型为 ,D的化学名称为 。
(3)①的化学方程式为 。
(4)J的结构简式为 。
(5)G的同分异构体中,苯环上的一氯代物只有一种的共有 种(不含立体异构),核磁共振氢谱显示2组峰的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
下列粒子半径大小的比较正确的是( )
A. Na+<Mg2+<Al3+<O2- B. S2->Cl->Na+>Al3+
C. Na<Mg<Al<S D. Cs<Rb<K<Na
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
电子层数相同的三种元素X、Y、Z,它们最高价氧化物对应的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4。下列判断中不正确的是( )
A. 阴离子的半径:X>Y>Z
B. 单质的氧化性:X>Y>Z
C. 元素的非金属性:X>Y>Z
D. 气态氢化物的稳定性:X>Y>Z
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
原子序数为83的元素位于:①第5周期;②第6周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( )。
A. ①④ B. ②③ C. ②④ D. ①⑤
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:简答题
有机物F是一种关节炎止痛药,合成F的一种传统法的路线如下:

(1)B中含氧官能团的名称为_________。
(2)C→D的反应可分为两步,其反应类型为_________、_________。
(3)写出比F少5个碳原子的同系物X的结构简式:_______________(写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有_______________种。
①属于芳香族化合物;②苯环上只有1个取代基;③属于酯类物质;
(4)写出E转化为F和无机盐的化学方程式:______________________。
(5)已知:①
②  (R1、R2表示烃基)
(R1、R2表示烃基)
合成F的一种改良法是以2—甲基—1—丙醇[(CH3)2CHCH2OH)]、苯、乙酸酐[(CH3CO)2O]为原料来合成,写出有关的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2 CH3CH2Br
CH3CH2Br CH3CH2OH__________________
CH3CH2OH__________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:实验题
二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:

已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
(3)“萃取”时存在反应:Ce4+ +n(HA)2 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比( )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。

(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① |
|
|
|
|
|
|
|
2 |
|
|
| ⑤ | ⑥ | ⑦ |
|
|
3 | ② | ③ | ④ |
|
|
| ⑧ |
|
4 |
|
|
|
|
|
| ⑨ |
|
5 |
|
|
|
|
|
| ⑩ |
|
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com