
Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类 ( )
A. 75%的酒精溶液 B. 硝酸钠 C. Fe(OH)3胶体 D. 豆浆
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列物质间的转化,能通过一步反应实现的是
A. S→SO3 B. Fe→FeCl2 C. CuO→Cu(OH)2 D. SiO2→H2SiO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1。滴入几滴石蕊溶液后,用石墨作电极电解该混合溶液,根据电极产物,电解过程可明显分为三个阶段。下列叙述中,不正确的是
A. 阴极自始至终只产生H2
B. 电解过程中,溶液颜色呈现红色→紫色→蓝色的变化
C. 电解过程中,Na+和SO2- 4的物质的量浓度保持不变
D. 第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:实验题
某同学按下列步骤配制500 mL 0.20 mol·L-1KCl溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需KCl的质量 |
|
(2)称量KCl固体 | 称量过程中主要用到的仪器是__________ |
(3)将KCl加入100 mL烧杯中,加适量蒸馏水溶解 |
|
(4)将烧杯中的溶液转移至500 mL容量瓶中,洗涤2至3次并将洗涤液转入容量瓶中 | 为防止溶液溅出,应该采取的措施是______________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______________________________ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. CO2的摩尔质量为44g
B. 5.4mL4℃的H2O中有1.806×1023个分子
C. 标准状况下,2.24L CCl4所含的原子数为0.5NA
D. 50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物质的量之和是0.1mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:简答题
(1)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某温度下,NO2(g)+SO2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某温度下,NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数K=
SO3(g)+NO(g)的平衡常数K=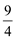 ,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示:
,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol·L-1 | 0.10 | 0.10 | 0.20 |
①10 min后,甲中达到平衡,则甲中反应的平均速率v(NO2)=___________。
②丙达到平衡所用的时间_______10 min(填“<”、“>”、“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_______________。
(2)研究铁及其化合物对生产生活具有重要的意义。一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
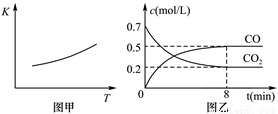
①反应ΔH__________0(填“<”或“>”)。
②下列措施中能使平衡时c(CO)/c(CO2)增大的是__________(填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
③一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。计算该反应的平衡常数K=_______。
(3)已知:CO(g)+2H2(g)=CH3OH (g) ΔH=-116 kJ·mol-1;
CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1;
H2 (g)+1/2O2(g)=H2O(g) ΔH=-242 kJ·mol-1 ;
写出CH3OH燃烧生成CO2和水蒸气的热化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、Na+、SO42-
B. c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、Cl-、NO3-
C. 水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
D. c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:推断题
(1)六种元素中第一电离能最小的是_____________(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___ _,1molAB一中含有π键的数目为__ ______(阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及____ (填序号)。
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如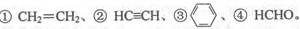 其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_ ___ 。金属C的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M g/mol,则表示C原子半径的计算式为 cm(不必化简)。
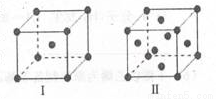
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 1.00mol NaCl中含有NA个NaCl 分子
B. 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA
C. 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA
D. 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com