

 ,其中反应(1)的条件是氢氧化钠水溶液、加热;
,其中反应(1)的条件是氢氧化钠水溶液、加热; ;
;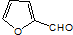 也能与化合物Ⅱ发生类似反应①的反应,除CH3COOH外,另一种有机产物的结构简式为
也能与化合物Ⅱ发生类似反应①的反应,除CH3COOH外,另一种有机产物的结构简式为 .
.分析 (1)根据化合物Ⅰ的结构简式书写分子式,苯环、醛基均与氢气发生加成反应;
(2)A.苯环为平面结构,-CHO为平面结构,二平面不一定共平面,
B.化合物Ⅱ中的含氧官能团是酯基;
C.化合物Ⅲ含有羧基,能与NaHCO3反应;
D.化合物Ⅲ含有碳碳双键和酚羟基,所以与Br2既能发生取代反应,也能发生加成反应;
(3)转化关系中-Cl转化为-OH,反应(1)发生卤代烃的水解反应,然后酸化得到化合物Ⅰ;
(4)化合物Ⅰ的同分异构体,定条件下能与NaOH溶液反应,其核磁共振氢谱中有 4种峰,峰面积之比为1:2:2:1,可以是-OH、-CHO处于对位;
(5)反应①的本质为醛基中氧原子与乙酸酐甲基中2个H原子脱去1分子水形成碳碳双键,再发生水解反应,据此判断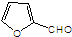 与化合物Ⅱ发生除CH3COOH外,另一种有机产物的结构简式;
与化合物Ⅱ发生除CH3COOH外,另一种有机产物的结构简式;
(6)乙烯与水发生加成反应得到乙醇,乙醇发生催化氧化得到乙醛.
解答 解:(1)由化合物Ⅰ的结构简式,可知其分子式为C7H6O2,含有1个苯环和1个醛基,则1mol化合物Ⅰ最多能与4 mol氢气发生加成反应,
故答案为:C7H6O2;4;
(2)A.苯环为平面结构,-CHO为平面结构,二平面不一定共平面,所有原子不一定位于同一平面,故A错误;
B.化合物Ⅱ中的含氧官能团是酯基,故B错误;
C.化合物Ⅲ含有羧基,能与NaHCO3反应,故C正确;
D.化合物Ⅲ含有碳碳双键和酚羟基,所以与Br2既能发生取代反应,也能发生加成反应,故D正确,
故选:CD;
(3)转化关系中-Cl转化为-OH,反应(1)发生卤代烃的水解反应,然后酸化得到化合物Ⅰ,反应(1)的条件为:氢氧化钠水溶液、加热,
故答案为:氢氧化钠水溶液、加热;
(4)化合物Ⅰ的一种同分异构体,定条件下能与NaOH溶液反应,其核磁共振氢谱中有 4种峰,峰面积之比为1:2:2:1,可以是-OH、-CHO处于对位,结构简式为: ,
,
故答案为: ;
;
(5)反应①的本质为醛基中氧原子与乙酸酐甲基中2个H原子脱去1分子水形成碳碳双键,再发生水解反应,可知 与化合物Ⅱ发生除CH3COOH外,另一种有机产物的结构简式为
与化合物Ⅱ发生除CH3COOH外,另一种有机产物的结构简式为 ,
,
故答案为: ;
;
(6)乙烯与水加成生成CH3CH2OH,CH3CH2OH在发生催化氧化合成CH3CHO,所以反应方程式为:①CH2=CH2+H2O$\stackrel{浓硫酸}{→}$CH3CH2OH;②2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
故答案为:CH2=CH2+H2O$\stackrel{浓硫酸}{→}$CH3CH2OH;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查有机物合成、有机物结构与性质、限制条件同分异构体书写、信息获取与迁移应用等,熟练掌握官能团的性质与转化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
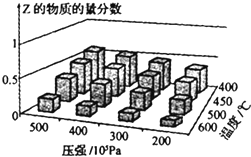
| A. | 在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 | |
| B. | 升高温度,正、逆反应速率都增大,平衡常数增大 | |
| C. | △H>0 m+n>c | |
| D. | 温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 试剂 | 操作方法 |
| A | 除去CH4中的C2H4 | 溴水 | 洗气 |
| B | 除去工业酒精中的水 | CaO | 蒸馏 |
| C | 除去苯中的溴 | 乙醇 | 分液 |
| D | 从肥皂、甘油的混合液中分离出肥皂 | NaCl | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ | |
| B. | 若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ | |
| C. | 若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间不相同 | |
| D. | 平衡时Ⅰ容器的体积小于V L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

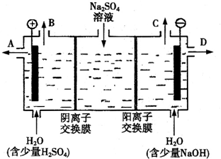
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 114号元素在周期表中第七周期第VIA族,属于金属元素 | |
| B. | 晶体硅熔点高硬度大,可用于制作光导纤维 | |
| C. | 光束通过下列分散系①有尘埃的空气②胆矾溶液③墨水④稀豆浆时,均产生丁达尔效应 | |
| D. | 为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com