
A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C, B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(l) B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为_______
(2) DA2分子的VSEPR模型是________。H3A比H2D熔沸点高得多的原因是_________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH 溶液反应可生成Na[C(OH)4]

①C2Cl6属于_________晶体(填晶体类型),其中C原子的杂化轨道类型为______杂化。
②[C(OH)4]-中存在的化学健有__________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_________。
(5)B、C的氯化物晶格能分别是2957KJ/mol、5492KJ/mol,二者相差很大的原因是________。
(6)D与E所形成化合物晶体的晶胞如右图所示。

①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2),c为(1/2,1/2,0).则d原子的坐标为__________。
③已知该晶胞的密度为ρg/cm3,则其中两个D,原子之间的距离为____pm(列出计算式即可)。
科目:高中化学 来源:2017届广东省肇庆市高三上学期二模化学试卷(解析版) 题型:选择题
一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )
A.充电时阴极发生氧化反应
B.充电时将碳电极与电源的正极相连
C.放电时碳电极反应为原电池的负极
D.放电时镍电极反应为Ni(OH)2-e-+OH-=NiO(OH)+H2O
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:填空题
合理应用和处理含氮的化合物,在生产生活中有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。

写出总反应化学方程式 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。

在2L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 。
25min时采取的措施是 。
③时段III条件下,反应的平衡常数表达式为 (只列计算表达式,不计算)。
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
在HNO2溶液中存在如下平衡:HNO2?H++NO2﹣,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是
A.NaOH溶液 B.硫酸溶液 C.NaNO2溶液 D.NaHSO4溶液
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
化学平衡主要研究下列哪一类反应的规律( )
A.部分反应 B.任何反应 C.可逆反应 D.气体反应
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三1月诊断性考试化学试卷(解析版) 题型:选择题
采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取绿矾(FeSO4·7H2O),某学习小组设计了如下流程:
下列说法错误的是
A.酸浸时选用足量硫酸,试剂X为铁粉
B.滤渣a主要含SiO2,滤渣b主要含Al(OH)3
C.从滤液B得到绿矾产品的过程中,必须控制条件防止其氧化和分解
D.试剂X若为过量NaOH溶液,得到的沉淀用硫酸溶解,再结晶分离也可得绿矾
查看答案和解析>>
科目:高中化学 来源:2017届山东省潍坊市临朐县高三12月阶段测化学试卷(解析版) 题型:填空题
硫及其化合物用途广泛,研究硫及其化合物性质和用途意义重大。
⑴利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+1/2O2(g) SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
①该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _________ v (逆)(填“<”、“>”或“=”)。
(逆)(填“<”、“>”或“=”)。
②该温度下,向一体积为2 L的恒容密闭容器中充入2.0 mol SO2和1.0 molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为_______________。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__________(填字母)。
A.保持 温度和容器体积不变,充入1.0 mol O2
温度和容器体积不变,充入1.0 mol O2
B.升高温度
C.保持温度和容器体积不变,充入1.0  mol SO3
mol SO3
D.增大容器体积
⑵室温下,Li /FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是___________________。
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产生物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等,请写出化学反应方程式:第一次放电:__________________;第二次放电:________________。
⑶制取高纯度黄铁矿的另一种方法是:以LiCl—KCl低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解,写出阳极方程式______________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省潍坊市临朐县高三12月阶段测化学试卷(解析版) 题型:选择题
化学与科技、生产、生活密切相关。下列说法错误的是
A.CaO可用作工业废气的脱硫剂
B.“玉兔号”月球车太阳能电池帆板的材料是二氧化硅
C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D. “天宫二号”中使用的碳纤维,是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期末化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. Na与乙醇反应时的反应速率比与水反应时的慢
B. 除去乙烷中混有的少量乙烯的方法可以是将其通入溴水中C﹒已知 和
和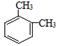 是同一种物质,说明苯分子中的碳碳键不是单双键交替的
是同一种物质,说明苯分子中的碳碳键不是单双键交替的
C. 苯不能使酸性高猛酸钾溶液褪色,所以苯不能发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com